Апластическая анемия
Содержание:
Апластическая анемия – механизм развития
В настоящее время существует три теории, объясняющих механизм развития апластической анемии. Каждая из них получила подтверждение в ходе исследований.
Внимание. В некоторых случаях ни одна из имеющихся теорий не может объяснить возникновение заболевания
При таком варианте используют название «идиопатическая апластическая анемия».
Поэтому официально теории приняты, но изучение механизмов возникновения апластической анемии продолжается.
Теории патогенеза (возникновения) апластической анемии:
- аутоиммунная;
- стромальная;
- преждевременный апоптоз.
Аутоиммунная теория
Справочно. В аутоиммунной теории за основу берется развитие иммунного ответа к клеткам костного мозга.
Возникла она в результате исследования материала биоптата костного мозга после развития апластической анемии.
В большом количестве случаев ученые увидели присутствие клеточного иммунитета (моноциты, Т-киллеры), а также факторов воспаления – фактор некроза опухолей, интенферон альфа и гамма.
После более детального изучения стало понятно, что скапливаются они из-за генной мутации. В результате нарушения работы гена PIG-A возникает дефицит специального гликопротеина, который необходим для того, чтобы снижать активность системы комплемента, входящей в состав иммунной системы.
В результате этой поломки защита собственных клеток костного мозга слабеет, они начинают восприниматься, как чужеродные и развивается аутоиммунная реакция. В зависимости от количества поврежденных клеток степень выраженности симптомов разнится.
Важно. Чем больше вовлечено ткани, тем более агрессивная анемия наблюдается у пациента.
Стромальная теория
Нормальное функционирование механизма кроветворения во многом зависит от стромы, то есть специального соединительнотканного основания, в котором находятся клетки костного мозга.
Строма отвечает за выработку специальных веществ (интерлейкины и факторы стволовых клеток), которые необходимы для направления недифференцированных молодых клеток по пути образования эритроцитов, тромбоцитов или лейкоцитов.
Стимулируется эта выработка эритропоэтином.
В случае нарушения выделения факторов роста на уровне стромы возникают низкодифференцированные клетки, которые не могут выполнять свои функции. Они не достигают дифференцировки, достаточной для определения в крови при анализе.
Справочно. Подтверждается данная теория при биопсии костного мозга – определяются предшественники клеток в большом количестве. А также определяется повышенный уровень эритропоэтина в крови. Такие изменения характерны не более чем для 20% случаев.
Теория преждевременного апоптоза
Термином апоптоз в медицине обозначают естественный процесс гибели клетки, когда она в полном объеме выполнила свою функцию. Происходит это во всех тканях организма. После определенного времени клетки подвергаются мутации, начинают восприниматься организмом, как старые, и удаляются.
В норме процесс представляет собой защитный механизм, который способствует обновлению тканей. Мутировавшие клетки могут переродиться в опухолевый процесс, и функция апоптоза – не допустить этого. Однако, если этот процесс начинает происходить раньше времени, возможно чрезмерное удаление клеток ткани. При недостаточном синтезе новых клеток этот процесс приводит к нарушению функции.
Справочно. Причиной слишком раннего удаления здоровых и молодых клеток является мутация гена, отвечающего за выработку протеина Р-450.
Изучение механизмов развития апластической анемии до сих пор является зоной научных интересов исследователей всего мира. Однако это может внести вклад в лечение заболевания в будущем, но никак не сказывается на современных пациентах.
Дело в том, что на сегодняшний момент самым эффективным методом лечения апластической анемии остается пересадка костного мозга. Для замедления процесса используют стероидные гормоны.
Внимание. Ни один из методов лечения не учитывает патогенез процесса.
Симптомы апластической анемии
Нарушения в работе костного мозга не могут протекать бессимптомно. В анализе крови появятся характерные изменения, а именно, все форменные элементы крови будут иметь запредельно низкий уровень. Безусловно, что качество жизни больного значительно ухудшится.
Иногда случается резкое начало анемии, когда на фоне общего здоровья, человек резко начинает себя плохо чувствовать. При этом развивается патология очень быстро, а лечение оказывается малоэффективным. Подобная клиническая картина наблюдается редко. Чаще всего анемия прогрессирует постепенно, поэтому человек долгое время может даже не подозревать о своем страшном диагнозе. Организм играет «злую шутку», включая адаптационные механизмы, тем самым перекрывая симптомы имеющегося нарушения. Это не позволяет начать своевременное лечение. Однако рано или поздно, признаки имеющегося нарушения все-таки себя проявляют, что заставляет человека обращаться за врачебной помощью. Поражение костного мозга приводит к тому, что у больного развиваются следующие патологические синдромы: анемический и геморрагический. Кроме того, повышается вероятность возникновения инфекционных осложнений.
К основным симптомам апластической анемии относят:
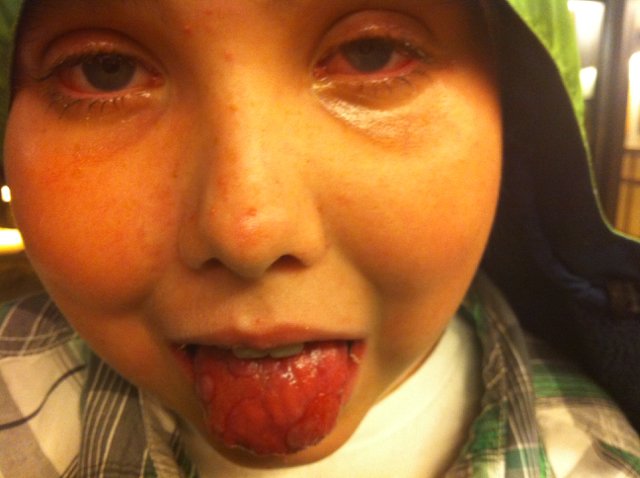
Если кроме нарушения формирования красных кровяных телец в костном мозге в недостаточной мере вырабатываются тромбоциты, то это будет сопровождаться кровотечениями. Ткани страдают от кислородного голодания, кожные покровы приобретают неестественную бледность. Человек часто испытывает головные боли, у него возникают приступы головокружения. При незначительном физическом усилии появляется одышка, которая в дальнейшем начнет развиваться даже в состоянии покоя. Ротовая полость подвергается атакам различных инфекционных агентов. В целом, человек испытывает постоянное недомогание и очень быстро устает.
Снижение уровня тромбоцитов влечет за собой появление подкожных кровоизлияний, десна начинают кровоточить. Время от времени возникают носовые кровотечения, у женщин усиливаются маточные кровотечения.
Уменьшение числа лейкоцитов ведет к падению иммунных сил организма. Ему будет все сложнее бороться с инфекциями, человек начинает часто и долго болеть. У него возникают отиты, воспаление легких, подкожные кровоизлияния могут осложняться гнойными инфекциями, нельзя даже исключать сепсис. Все заболевания сопровождаются значительным повышением температуры тела.
В сердце появляются шумы, которые врач может прослушать во время аускультации.
Эритроциты в крови подвергаются массивному разрушению, что влечет за собой выделение в окружающую среду гемоглобина. В результате процесса гемолиза кожные покровы человека начинают отдавать желтизной. Гемолиз является признаком того, что имеется не только снижение уровня эритроцитов в крови, но и их качественные повреждения.
По мере прогрессирования заболевания, в размерах начинает увеличиваться печень и селезенка.
Острая анемия чаще всего развивается именно при приобретенной форме болезни. Сверхтяжелая степень заболевания очень быстро прогрессирует, лечить ее сложно. Буквально за несколько недель человека может не стать. Установлено, что лечение Левомицетином в 10 раз повышает вероятность развития сверхтяжелой апластической анемии.
Хроническое течение патологического процесса чаще всего наблюдается при врожденной и наследственной анемии. Периоды затишья сменяются периодами обострения. При такой клинической картине сохраняются шансы на полноценное выздоровление.
Причины развития
Многих интересует вопрос, что такое апластическая анемия и почему она появляется? К сожалению, современная медицина не может назвать очевидные причины развития апластической анемии у человека. Но известно, что болезнь бывает приобретённая и наследственная.
Существует теория, что развитие патологии связано с особенностями функционирования организма каждого индивида. Тем не менее отмечаются некоторые факторы, которые могут спровоцировать появление болезни. В частности, самым ясным из факторов является воздействие на человека ионизирующей радиации, которая подавляет функции костного мозга и приводит к снижению выработки им эритроцитов, тромбоцитов и лейкоцитов. Также к предрасполагающим факторам можно отнести следующие:
- плохая экологическая ситуация в регионе;
- регулярные контакты человека с вредными химическими веществами;
- некоторые инфекционные патологии, в частности, гепатит, цитомегаловирусная инфекция;
- проблемы с костным мозгом;
- приём некоторых медикаментов, в том числе обычных жаропонижающих и обезболивающих средств типа аспирина;
- частый приём антибиотиков, особенно левомицетина.
Обнаружено, что болезнь наблюдают у пациентов с чрезмерной тягой к алкоголю. Не последнюю роль в развитии болезни играет и генетическая предрасположенность. Апластическая анемия у детей часто развивается вследствие наследственных патологий, в том числе этом может быть анемия Фанкони. Необходимо отметить, что зачастую у детей диагностируется идиопатическая апластическая анемия – то есть патология с неясной этиологией.
Что касается такой патологии, как гипопластическая апластическая анемия – то это ещё более тяжёлая патология, вызывающая серьёзные нарушения в работе всех внутренних органов и приводящая к нарушению работоспособности систем организма.
Также следует сказать, что апластическая анемия бывает трёх форм тяжести:
- очень тяжелая (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелая (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренная (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Апластическую анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией.
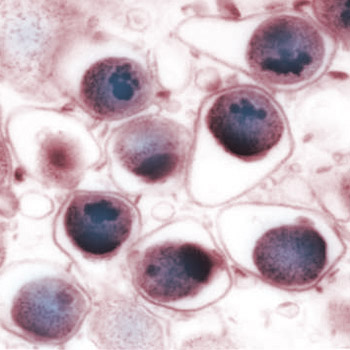
Мегалобластные анемии
— анемии,
связанные с нарушением синтеза ДНК и
РНК,— заболевания, для которых характерно
наличие в костном мозге мегалобластов
— клеток красного ряда, характеризующихся
большой величиной, нежной структурой
хроматина в ядре, асинхронной
дифференцировкой ядра и цитоплазмы.
Основные
клинические проявления
Мегалобластные
анемии часто развиваются постепенно.
Вначале появляется слабость, повышенная
утомляемость, диспепсические расстройства,
сухость во рту. У некоторых больных
могут быть парестезии, корешковые боли.
При нарастании анемии появляются
головокружения, шум в ушах, сердцебиения,
одышка. Кожные покровы бледные с
ли-монно-желтым оттенком, склеры
субиктеричны. Отмечается гипотония;
на верхушке часто прослушивается
систолический шум, который проводится
на сосуды. При осмотре языка видны
участки воспаления. Нередко при этом
больные жалуются на чувство жжения
в языке. В последующем язык приобретает
гладкий, блестящий вид (лакированный
язык). Аппетит у больных обычно снижен.
Неврологическая симптоматика
проявляется онемением конечностей,
парестезиями, мышечной атрофией. Возможны
психические нарушения: бред, галлюцинации.
Классификация
1.
Анемии, связанные с дефицитом цианкобаламина
(витамина В12);
2.
Анемии, связанные с дефицитом фолиевой
кислоты. Диагностические критерии
В12-дефицитной
анемии:
1)
снижение содержания эритроцитов (менее
3,01012/л);
2) повышение цветового
показателя (более 1,1);
3) повышение содержания
гемоглобина в эритроцитах;
4) увеличение в крови
количества макроцитов, появление
мегалоцитов;
5) появление в костном
мозге мегалобластов;
6) повышение содержания
сывороточного железа (более 30,4 мкмоль
на литр).
Диагностические
критерии
Диагностические
критерии анемий, обусловленных дефицитом
фолиевой кислоты — в периферической
крови появляются макроциты, определяется
гиперхром-ная анемия с анизоцитозом,
тромбоцитопения, лейкопения, в костном
мозге обнаруживаются мегалобласты;
содержание фолиевой кислоты снижено
как в сыворотке (менее 3 мг/мл), так и
в эритроцитах (менее 100 мг/мл)
Примеры
формулировки диагноза
1. Анемия Аддисона-Бирмера,
стадия ремиссии.
2.
В12-дефицитная
анемия, обусловленная нарушением
транспорта цианкобаламина, стадия
рецидива с выраженным циркуляторно-гипоксическим
и гематологическим синдромами.
3. Фолиево-дефицитная
анемия, стадия ремиссии.
Гипопластическая анемия
Гипопластическая анемия (греческий hypo- + plasis формирование, образование; анемия; синонимы: апластическая анемия, арегенераторная анемия, геморрагическая алейкия, миелопарез, миелофтиз, панмиелофтиз, прогрессирующая гипоцитемия) — заболевание системы крови, характеризующееся угнетением кроветворной функции костного мозга и проявляющееся недостаточным образованием эритроцитов, лейкоцитов и тромбоцитов (пангемоцитопенией) или только одних эритроцитов (парциальная гипопластическая анемия, эритробластофтиз).
Классификация
Различают врождённые (конституциональные) и приобретённые формы Гипопластическая анемия. Врождённые Гипопластическая анемия встречаются сравнительно редко. В зависимости от характера угнетения кроветворения выделяют формы с поражением всех трёх ростков (истинная Гипопластическая анемия) или только эритропоэза (парциальная Гипопластическая анемия). Иногда выделяют Гипопластическая анемия с гемолитическим компонентом, но некоторые авторы считают, что она представляет собой гипопластическую стадию пароксизмальной ночной гемоглобинурии (смотри полный свод знаний Гемолитическая анемия).
История
В 1888 год П. Эрлих описал заболевание у молодой женщины, при котором остро развилась кровоточивость, лихорадка, глубокая анемия и лейкопения (тромбоциты в то время не подсчитывали); на вскрытии отсутствовали признаки кроветворения в костном мозге, что П. Эрлих объяснял первичным угнетением его функции. Термин «апластическая анемия» впервые предложил Шоффар (А. М. Chauffard, 1904). В дальнейшем была выделена апластическая анемия типа Эрлиха, при которой наряду с неуклонно прогрессирующей панцитопенией, нередко осложнённой сепсисом, резко выраженными геморрагиями и некротическими явлениями, гистологически в костном мозге не выявлялись признаки кроветворения; болезнь наблюдалась у лиц в возрасте от 18 до 20 лет. Сходное заболевание под названием «геморрагическая алейкия» описал Франк (Е. Frank, 1915). С введением в практику в 1927 г. М. И. Аринкиным пункционного исследования костного мозга появилась возможность отличать истинные Гипопластическая анемия от панцитопений, обусловленных лейкозным или метастатическим поражением костного мозга. В отечественной литературе первые описания Гипопластическая анемия под названием «клинико-гематологический синдром» принадлежат Г. П. Хосроеву (1913). Гипопластическая анемия как отдельной нозологический форме посвящены работы X. X. Владоса (1937), Е. А. Кост (1952), И. А. Кассирского и Г. А. Алексеева (1962), Ф. Э. Файнштейна (1965), Г. С. Мухамедзяновой (1970) и другие.
Статистика детально не изучена. По статистическим данным московских прозектур, частота Гипопластическая анемия составляла в 1928—1932 гг. 0,009%, в 1945—1950 годы 0,13%, в 1951 — 1956 годы 0,25%. В США (по данным штата Калифорния, 1967) заболеваемость Гипопластическая анемия составляла 2 случая на 1 млн. чел., или 1:400 000 — 1:700 000. Выраженной зависимости заболеваемости от пола, возраста и этнической принадлежности не установлено.
Этиология
Гипоплазия кроветворения может быть обусловлена воздействием разнообразных внешних факторов, которые принято делить на две группы: 1) факторы с облигатным миелотоксическим эффектом, пропорциональным величине дозы, — ионизирующая радиация, бензол и его производные (развивается бензольная анемия), противоопухолевые препараты (хлорэтиламины; фосфорамиды; антиметаболиты — антагонисты фолиевой к-ты, аналоги пуринов, пиримидинов и другие; антимитотические средства — колхицин, алкалоиды барвинка; антибиотики — брунеомицин, рубомицин, адриамицин, карминомицин), неорганические соединения мышьяка, эстрогены и другие; 2) факторы с факультативным миелотоксическим эффектом, обнаруживаемым лишь в единичных случаях — антибактериальные, противосудорожные, антитиреоидные, антигистаминные препараты, транквилизаторы (развивается апластическая постмедикаментозная анемия), инсектициды и другие; прямой связи развития Гипопластическая анемия с дозой и длительностью применения препарата в этих случаях не отмечается.
Причины возникновения апластической анемии
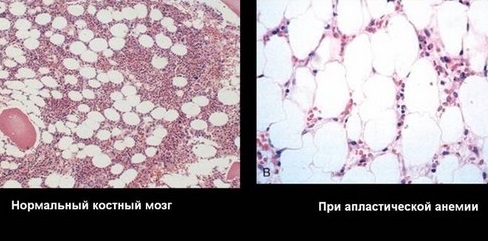
Апластическая анемия — это гематологический синдром, обусловленный действием большого количества экзогенных и эндогенных факторов. Характерным его признаком являются качественные и количественные изменения клеток гемопоэза и их микроокружения с развитием панцитопении в периферической крови, гипоклеточности и жировой инфильтрации костного мозга.
Определяют два возрастных пика заболеваемости апластической анемией — 20 и 65 лет. В связи с этим существует мнение о возможной этиологической роли вирусов (в молодом возрасте) и химических веществ (в пожилом). Однако большинство авторов склонны считать апластическую анемию полиэтиологическим заболеванием.
Вероятную причину возникновения апластической анемии выявляют примерно у 50% больных. К возможным этиологическим факторам относятся:
- некоторые лекарственные препараты (антибиотики, сульфаниламидные препараты, препараты золота, нестероидные противовоспалительные и успокаивающие средства, транквилизаторы, цитостатики и т.п.),
- химические вещества (пары ртути, кислот, красители, лаки, краски, средства бытовой химии, бензин, бензол, урсол и т.п.),
- физические факторы (радионуклиды),
- инфекционные агенты (вирусы гепатитов В, С, ретровирусы, микобактерия туберкулеза и т.д.),
- аутоиммунные процессы и заболевания (системная красная волчанка, синдром Шегрена, эозинофильный фасциит и т.п.).
В развитии апластической анемии имеет значение генетическая предрасположенность и индивидуальная реактивность организма. Рассматривают три главные концепции возможных механизмов возникновения нарушений костномозгового кроветворения при апластической анемии:
- поражение стволовых кроветворных клеток,
- нарушение иммунологического контроля за процессами гемопоэза (клеточного и гуморального),
- дефектность кроветворения микроокружения.
Первые клинические проявления апластической анемии бывают различными. Острое начало наблюдается в 12-15% больных. Для него характерны быстрое развитие анемии, выраженный геморрагический синдром, часто — лихорадка с ознобом. Острое начало обычно наблюдают с молодых людей. Чаще апластическая анемия развивается постепенно, проявляется анемичным и геморрагическим синдромами. Ход определяют у 85% больных апластической анемией.
Поводом для первичного обращения к врачу может быть нарастающая общая слабость, вялость, бледность, появление одышки и сердцебиения при ходьбе, боли в области сердца как признак анемической гипоксии. Иногда наблюдаются геморрагические проявления различной степени и локализации — кровотечения носовые и с десен, кожные геморрагии (от мелкоточечных до сплошных), меноррагия. Нередко возникают гематурия, кровотечения из пищеварительного тракта.
В 84% больных во время офтальмоскопии обнаруживают кровоизлияния в сетчатку. Часто наблюдают горячку, обусловленную некротическими изменениями слизистых оболочек ротовой полости, пищеварительного тракта, нагноением обширных кровоизлияний во внутренних органах и тканях. Таким образом, клинические проявления апластической анемии непосредственно связаны с изменениями в периферической крови (анемия, лейкопения, тромбоцитопения) и охватывают соответственно тощий, геморрагический синдромы и синдром инфекционных осложнений.
Для апластической анемии не характерны спленомегалия, гепатомегалия, увеличение лимфатических узлов. Увеличение размеров печени можно наблюдать разве что у лиц, переболевших гепатитом, а селезенки — у пациентов, которым неоднократно проводили гемотрансфузии. Апластическая анемия чаще развивается в течение длительного времени (месяцы и годы), может сопровождаться сначала редукцией одного из ростков кроветворения с постепенными изменениями со стороны всех ростков.
Что такое апластическая анемия
Апластическая анемия — это патологическое состояние организма, при котором костный мозг перестает вырабатывать все три типа клеток крови: красные кровяные тельца (эритроциты), белые кровяные тельца (лейкоциты) и тромбоциты (тромбоциты). Это происходит, когда по какой-то причине в костном мозге уменьшается количество стволовых клеток, из которых развиваются все клетки крови.
Точнее сказать — это синдром недостаточности костного мозга, характеризующийся снижением количества эритроцитов, лейкоцитов, тромбоцитов в крови и гипоплазией костного мозга с менее чем 30% гематопоэтических клеток.
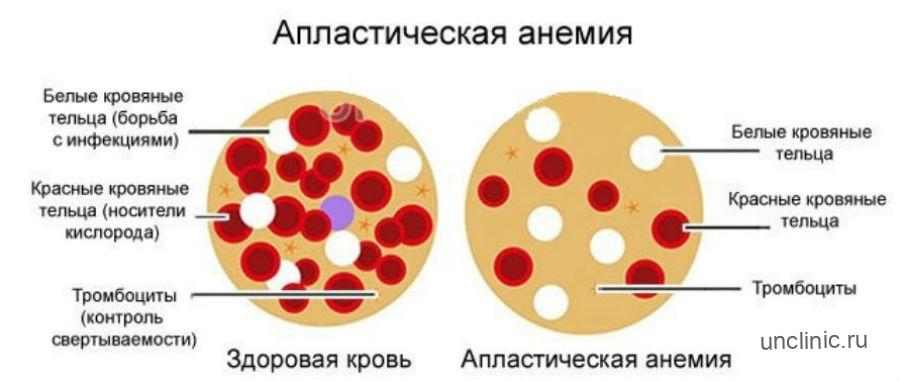
Что такое апластическая анемия
Апластическая анемия подразделяется на первичную и вторичную.
- Первичная — анемия Фанкони, врожденный склероз и семейная апластическая анемия.
- Вторичная — анемия, вызванная химическими веществами, лекарствами, вирусами.
Диагностика апластической анемии
Наиболее ценными дополнительными исследованиями являются:
- общий анализ крови (ОАК);
- биохимический анализ крови (БАК);
- стернальная пункция;
- трепанобиопсия.
Общий анализ крови
снижение количества всех трех типов клеток костного мозганейтрофилы, эозинофилы и базофилыОриентировочными показателями ОАК при апластической анемии являются:
- Гемоглобин (Hb) – менее 110 г\л (норма 120 – 160 г\л). Уменьшение за счет снижения числа эритроцитов.
- Эритроциты – 0,7 – 2,5 х 1012\л (норма 3,7 х 1012\л). Снижение количества зрелых эритроцитов.
- Ретикулоциты — менее 0,2% (норма 0,3 – 2,0%). Снижение количества молодых форм эритроцитов.
- Цветовой показатель – 0,85 – 1,05 (норма 0,85 – 1,05) свидетельствует о нормохромном характере анемии (содержание гемоглобина в эритроците в пределах нормы).
- Гематокрит (Ht) – менее 30 (норма 35 – 42 у женщин и 40 – 46 у мужчин). Соотношение клеточного состава крови к ее жидкой части. Наблюдается явное уменьшение доли клеток в периферической крови.
- Тромбоциты – менее 35 промилле или 100 х 109\л. Снижение количества тромбоцитов.
- Лейкоциты – 0,5 – 2,5 х 109\л (норма 4 – 9 х 109\л). Выраженная лейкопения за счет снижения числа гранулоцитов (нейтрофилы, эозинофилы и базофилы).
- Палочкоядерные нейтрофилы – 0 – 2% (норма менее 6%). Снижение выработки молодых форм лейкоцитов.
- Сегментоядерные нейтрофилы – 0 – 40% (норма 47 – 72%). Снижение количества зрелых форм нейтрофилов.
- Миелоциты – 0 – 2% (в норме отсутствуют). В условиях гранулоцитопении и наслоения бактериальной инфекции наблюдается более выраженный, чем обычно, сдвиг лейкоцитарной формулы влево с появлением клеток предшественников лейкопоэза.
- Эозинофилы – 0 – 1% (норма 1 – 5%). Снижение количества эозинофилов.
- Базофилы – 0% (норма 0 – 1%). Единичные или полное отсутствие базофилов.
- Лимфоциты – более 40% (норма 19 – 37%). Численное количество лимфоцитов остается в норме. За счет снижения фракции гранулоцитов наблюдается относительный лимфоцитоз (увеличение доли лимфоцитов в крови). Крайне выраженный лимфоцитоз может наблюдаться при наслоении вирусных инфекций.
- Моноциты – более 8% (норма 6 – 8%). Количество моноцитов неизменно и находится в пределах нормы. Моноцитоз (увеличение доли моноцитов в крови) объясняется снижением процентной доли гранулоцитов в лейкоцитарной формуле.
- Скорость оседания эритроцитов – более 15 – 20 мм\час (норма до 10 мм/час у мужчин и до 15 мм/час у женщин). Данный показатель отражает степень выраженности воспалительной реакции в организме.
- Анизоцитоз – наличие в крови эритроцитов различного размера.
- Пойкилоцитоз – наличие в крови эритроцитов различной формы.
Биохимический анализ крови
Ориентировочными показателями БАК при апластической анемии являются:
- Сывороточное железо более 30 мкмоль\л (норма 9 – 30 мкмоль/л). Увеличение сывороточного железа на фоне частых переливаний крови. Высокий риск развития гемохроматоза.
- Эритропоэтин более 30 МЕ\л (норма 8 – 30 МЕ/л у женщин и 9 – 28 МЕ\л у мужчин). Увеличение эритропоэтина происходит по двум причинам. Во-первых, не происходит его потребления клетками эритроцитарного ростка. Во-вторых, компенсаторно усиливается его синтез в ответ на анемию.
- НBs-АГ и анти HBcor иммуноглобулины G – положительны (в норме — отрицательны). Данный анализ указывает на наличие вирусного гепатита В. В ряде случаев данный вирус провоцирует развитие аутоиммунной реакции против клеток костного мозга.
- С-реактивный белок – более 10 – 15 мг\л (норма 0 – 5 мг\л). Выявляется при воспалительной реакции на фоне ослабленного иммунитета.
- Тимоловая проба – более 4 (норма 0 — 4). Выявляет признаки воспаления при ослабленном иммунитете.
Трепанобиопсия
миелограммыАпластическая анемия средней тяжести определяется следующими показателями:
- гранулоциты менее 2,0 х 109\л;
- тромбоциты менее 100 х 109\л;
- ретикулоциты менее 2 – 3%;
- гипоплазия костного мозга на трепанобиопсии.
Апластическая анемия тяжелой степени определяется следующими показателями:
- гранулоциты менее 0,5 х 109\л;
- тромбоциты менее 20 х 109\л;
- ретикулоциты менее 1%;
- аплазия костного мозга на трепанобиопсии.
Апластическая анемия крайне тяжелой степени определяется следующими показателями:
- гранулоциты менее 0,2 х 109\л;
- тромбоциты единичные или отсутствуют;
- ретикулоциты единичные или отсутствуют;
- аплазия костного мозга на трепанобиопсии.