Бактериофаг
Содержание:
- История
- Препараты бактериофагов: их использование, преимущества и недостатки
- Строение бактериофагов
- Преимущества и недостатки
- Размножение
- Морфология и структура
- Значение
- Систематика бактериофагов
- Диагностическая и терапевтическая роль фагов
- Жизненный цикл
- Бактерии vs. Человечество: глобальное сопротивление
- Строение и химический состав
- Жизненный цикл бактериофагов
- Факт 6: Бактериофаги используются для борьбы с вредоносными бактериями
- Бактериофаги: виды и назначение
История
Английский бактериолог Фредерик Туорт в статье 1915 года описал инфекционную болезнь стафилококков, возбудитель которой проходил через фильтры, и его можно было переносить от одной колонии к другой.
Независимо от Фредерика Туорта французско-канадский микробиолог Феликс Д’Эрелль 3 сентября 1917 года сообщил об открытии бактериофагов. Наряду с этим известно, что российский микробиолог Николай Фёдорович Гамалея ещё в 1897 году впервые наблюдал явление лизиса бактерий (сибиреязвенной палочки) под влиянием перевиваемого агента.
После открытия явлений бактериофагии Д’Эрелль развил учение о том, что бактериофаги патогенных бактерий, являясь их паразитами, играют большую роль в патогенезе инфекций, обеспечивая выздоровление больного организма, а затем создания специфического иммунитета
Это положение привлекло к явлению бактериофагии внимание многих исследователей, которые предполагали найти в фагах важное средство борьбы с наиболее опасными инфекционными болезнями человека и животных.. Также Феликс Д’Эрелль выдвинул предположение, что бактериофаги имеют корпускулярную природу. Однако только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов
Долгое время представления о морфологии и основных особенностях фагов основывались на результатах изучения фагов группы Т — Т1, Т2,…, Т7, которые размножаются на Е. coli штамма B. Однако с каждым годом появлялись новые данные, касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации
Однако только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов. Долгое время представления о морфологии и основных особенностях фагов основывались на результатах изучения фагов группы Т — Т1, Т2,…, Т7, которые размножаются на Е. coli штамма B. Однако с каждым годом появлялись новые данные, касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации.
Также Феликс Д’Эрелль выдвинул предположение, что бактериофаги имеют корпускулярную природу. Однако только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов. Долгое время представления о морфологии и основных особенностях фагов основывались на результатах изучения фагов группы Т — Т1, Т2,…, Т7, которые размножаются на Е. coli штамма B. Однако с каждым годом появлялись новые данные, касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации.
Препараты бактериофагов: их использование, преимущества и недостатки
Бактериофаги – это специфические вирусы, разрушающие патогенные и условно-патогенные для человеческого организма бактерии. Эти микроорганизмы безопасны для человека, то есть не могут вызвать развитие заболеваний.
Бактериофаги могут применяться как для лечения, так и для профилактики кишечной патологии.
Для чего применяются?
Бактериофаги применяются в комплексном лечении и профилактике кишечных инфекций. Их использование целесообразно при:
- повторяющихся эпизодах кишечных инфекций;
- резистентности к антибиотикам;
- аллергических реакциях на антимикробные препараты;
- возможном риске тяжелых системных реакций;
- тяжелой сопутствующей хронической патологии;
- маленьком возрасте пациента (до 1 года).
Целесообразность применения того или иного бактериофага определяет врач-инфекционист или гастроэнтеролог. Для начала такого специфического лечения необходимо специфическое подтверждение диагноза кишечной инфекции, то есть обнаружение патогенной бактерии в биологической жидкости пациента.
Механизм действия бактериофагов
По механизму действия различают такие виды:
- Умеренные бактериофаги. Внедряются в бактериальную клетку, изменяют некоторые процессы ее метаболизма, но не оказывают прямого цитопатического эффекта. Клетка патогенной бактерии погибает в результате прекращения важнейших биохимических реакций.
- Вирулентные (патогенные) бактериофаги. Разрушают клетку патогенной бактерии, то есть вызывают ее лизис, поэтому называются фаголизатами. После разрушения патогенной бактериальной клетки наружу выходят фаговые клетки, которые могут заражать и разрушать новые бактериальные клетки.
Бактериофаги, даже поливалентные не оказывают какого-либо воздействия на собственную нормальную микрофлору кишечника. Все виды фаголизатов действуют только в просвете кишечника, то есть не всасываются и не попадают в системный кровоток. Именно поэтому вероятность побочных эффектов у пациентов любого возраста практически нулевая.
Преимущества и недостатки бактериофагов
| Преимущество бактериофагов | Недостатки бактериофагов |
|
|
Некоторые преимущества бактериофагов можно рассматривать как оборотную сторону медали, то есть определенное достоинство рассматривается как недостаток.
Сравнение бактериофагов и антибиотиков
Сравнивать бактериофаги и антибиотики не совсем правильно, так как это разные фармацевтические группы. Следует отметить несколько наиболее важных моментов:
антибиотики обладают широким спектром действия (против многих бактерий), а бактериофаги узкоспецифичны;
для назначения бактериофага нужно знать вид микроба, а при антибиотикотерапии это не всегда важно;
длительность применения бактериофагов больше, чем антибиотиков;
к бактериофагам не развивается устойчивость, а к антибиотикам развивается;
бактериофаги не вызывают системных побочных эффектов в отличие от антибиотиков;
бактериофаги можно применять пациентам любого возраста, а антибиотики имеют возрастные ограничения.
Решающее слово в выборе антибиотика или бактериофага принадлежит врачу.
Можно ли принимать препараты бактериофагов для профилактики?
Бактериофаги – это лекарственные средства для лечения и профилактики кишечных инфекций. Следует отметить, что профилактический эффект бактериофага сохраняется недолго – не более суток. Для предотвращения заражения тем или иным возбудителем кишечной инфекции необходимо постоянно пить бактериофаг, что технически невозможно.
Целесообразно использовать это лекарственное средство при высоком риске инфицирования, например, при непосредственном контакте с больным кишечной инфекцией.
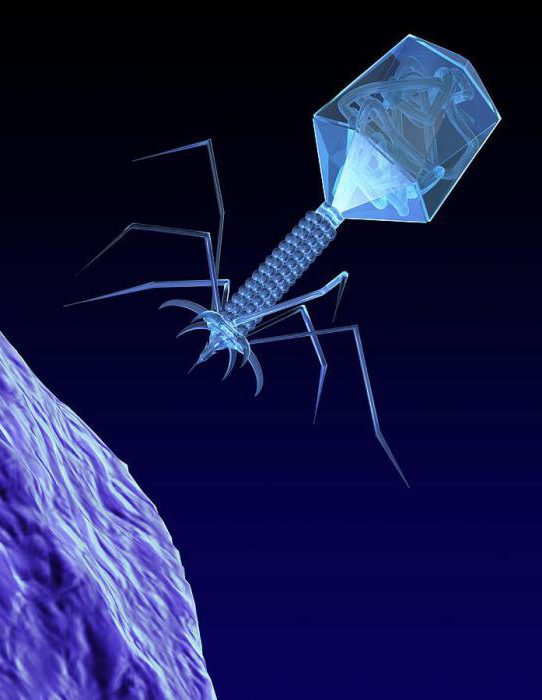
Строение бактериофагов
1 — головка, 2 — хвост, 3 — нуклеиновая кислота, 4 — капсид, 5 — «воротничок», 6 — белковый чехол хвоста, 7 — фибрилла хвоста, 8 — шипы, 9 — базальная пластинка
Бактериофаги различаются по химической структуре, типу нуклеиновой кислоты, морфологии и характеру взаимодействия с бактериями. По размеру бактериальные вирусы в сотни и тысячи раз меньше микробных клеток.
Типичная фаговая частица (вирион) состоит из головки и хвоста. Длина хвоста обычно в 2—4 раза больше диаметра головки. В головке содержится генетический материал — одноцепочечная или двуцепочечная РНК или ДНК с ферментом транскриптазой в неактивном состоянии, окружённая белковой или липопротеиновой оболочкой — капсидом, сохраняющим геном вне клетки.
Нуклеиновая кислота и капсид вместе составляют нуклеокапсид. Бактериофаги могут иметь икосаэдральный капсид, собранный из множества копий одного или двух специфичных белков. Обычно углы состоят из пентамеров белка, а опора каждой стороны из гексамеров того же или сходного белка. Более того, фаги по форме могут быть сферические, лимоновидные или плеоморфные.
Хвост, или отросток, представляет собой белковую трубку — продолжение белковой оболочки головки, в основании хвоста имеется АТФаза, которая регенерирует энергию для инъекции генетического материала. Существуют также бактериофаги с коротким отростком, не имеющие отростка и нитевидные.
Головка округлой, гексагональной или палочковидной формы диаметром 45—140 нм. Отросток толщиной 10—40 и длиной 100—200 нм. Одни из бактериофагов округлы, другие нитевидны, размером 8×800 нм. Длина нити нуклеиновой кислоты во много раз превышает размер головки, в которой находится в скрученном состоянии, и достигает 60—70 мкм. Отросток имеет вид полой трубки, окружённой чехлом, содержащим сократительные белки, подобные мышечным. У ряда вирусов чехол способен сокращаться, обнажая часть стержня. На конце отростка у многих бактериофагов имеется базальная пластинка, от которой отходят тонкие длинные нити, способствующие прикреплению фага к бактерии. Общее количество белка в частице фага — 50-60%, нуклеиновых кислот — 40-50%.
Фаги, как и все вирусы, являются абсолютными внутриклеточными паразитами. Хотя они содержат всю информацию для запуска собственной репродукции в соответствующем хозяине, у них нет механизмов для выработки энергии и рибосом для синтеза белка. Размер известных фаговых геномов варьирует от нескольких тысяч до 498 тысяч пар оснований (геном фага G, поражающего бацилл).
Преимущества и недостатки
Доказано, что лечение бактериофагами является наиболее безопасной заменой пенициллиновой терапии в лечении бактериальных инфекций. Среди основных преимуществ выделяют следующие:
- Они обладают намного меньшим количеством побочных эффектов, в сравнении с антибиотиками. Замечено, что на бактериофаги крайне редко отмечается аллергическая реакция, и гораздо реже происходит вторичные отрицательные эффекты в организме человека.
- Сочетаются с совершенно любыми видами препаратов, в том числе и пенициллинового ряда, не вызывают привыкания.
- Все препараты имеют очень удобную для потребителя форму выпуска: растворы для приёма перорально или таблетки.
- При продолжительном использовании фагов, не отмечается угнетения иммунной системы.
- Излечивают даже неострые, вялотекущие воспалительные процессы и вирусы, при которых использовать антибиотики считается нецелесообразным.
- В отличие от других медикаментов, к которым у большинства вирусов и микробов развивается постепенная резистентность, адаптироваться к фагам, вредным микроорганизмам практически невозможно.
Но, стоит отметить, что подобная терапия имеет и ряд недостатков, которые также следует учесть перед началом лечения. К ним относятся такие:
- вероятность переноса генома бактерии между микроорганизмами;
- сложности с подбором наиболее подходящей для лечения группой бактериофагов;
- общий курс терапии вируса занимает не менее 20 дней, в то время, как лечение антибиотиками проходит всего 3–7 суток.
https://youtube.com/watch?v=CEGISNgI2BI
Бактериофаги в педиатрии
 Использование фагов при лечении детских инфекционных заболеваний требует особенно тщательной диагностики и подбора препарата. Перед назначением, ребёнку необходимо пройти бактериостатический и бактериологический анализ на состояние микрофлоры.
Использование фагов при лечении детских инфекционных заболеваний требует особенно тщательной диагностики и подбора препарата. Перед назначением, ребёнку необходимо пройти бактериостатический и бактериологический анализ на состояние микрофлоры.
Как грудничкам, так и детям более старшего возраста бактериофаги назначаются при лечении следующих заболеваний:
- Инфекции органов слуха.
- Воспалительные процессы органов дыхания (горла, трахеи, носоглотки, лёгких, носа, гортани).
- Инфекции мочеполовой системы.
- Глазные заболевания с имеющимся воспалительным процессом (поражение роговицы, конъюнктивит).
- Инфекционные процессы желудочно-кишечного тракта (холецистит, гастроэнтероколит, дисбактериоз).
- Гнойные раны, хирургические инфицирования, абсцессы, ожоги, фурункулёзы и многое другое.
Лечение бактериофагами допустимо и для детей самого младшего возраста, поскольку эти медикаменты обладают намного более низким процентом побочных эффектов и не наносят вреда чувствительной микрофлоре кишечника у новорождённого.
Правила, которых необходимо придерживаться во время лечения:
- Перед тем как ввести бактериофаг грудничку или ребёнку постарше – необходимо провести при помощи клизмы обязательный ректальный тест на переносимость. У маленьких детей нередко происходит реакция отторжения в виде обильного срыгивания или поноса.
- Перед тем как проводить лечение Интести препаратом, который назначается при желудочно-кишечных инфекциях у детей, следует обязательно уточнить дозировку у педиатра.
- Перед применением этих препаратов для грудного ребёнка, может потребоваться ряд дополнительных анализов и тестов на переносимость препарата.
https://youtube.com/watch?v=v4ozRLuYUlg
Размножение
Бактериофаг прикрепляется своим отростком к бактериальной клетке и, выделяя фермент, растворяет клеточную стенку; затем содержимое его головки через канадец отростка переходит внутрь клетки, где под влиянием нуклеиновой кислоты фага останавливается синтез бактериальных белков, ДНК и РНК и начинается синтез нуклеиновой кислоты, а затем и белков фага. Часть этих белков — ферменты, другая часть образует оболочку зрелой частицы Б. Более мелкие, сферические фаги попадают в бактерии без участия отростка. Если клетка бактерии заражена одновременно частицами Б., различающимися между собой по ряду свойств, то среди потомства, кроме частиц, подобных родителям, будут и такие, у которых эти свойства встречаются в новой комбинации, т. к. при размножении Б. наблюдается рекомбинация — обмен кусками нитей нуклеиновой кислоты, являющейся носителем наследственной информации. Частицы крупных фагов выходят из бактерии, разрушая её, а некоторых мелких и нитевидных — из живых бактерий (см. Вирусы). Одни Б. весьма специфичны и способны лизировать клетки только одного какого-либо вида микроорганизмов (монофаги), другие — клетки разных видов (полифаги).
Бактериофаги делят на вирулентные, вызывающие лизис клетки с образованием новых частиц, и умеренные (симбиотические), которые адсорбируются клеткой и проникают в неё, но лизиса не вызывают, а остаются в клетке в латентной (скрытой) неинфекционной форме (профаг). Культуры, содержащие латентный фаг, называются лизогенными. Лизогения передаётся потомству бактерии. Лизогенная культура может содержать 2—3 и более фагов; она, как правило, устойчива против находящихся в ней фагов (лишь небольшая часть клеток лизируется и освобождает зрелые фаги). Воздействуя на лизогенную культуру ультрафиолетовыми или рентгеновскими лучами, перекисью водорода и некоторыми другими веществами, можно значительно увеличить количество клеток, освобождающих фаг (т. н. индукция Б.). Лизогения широко распространена среди всех видов бактерий и актиномицетов. В ряде случаев многие свойства лизогенной культуры (токсичность, подвижность бактерий и др.) зависят от наличия в ней определённых профагов. Описано много мутаций Б., сопровождающихся изменением их литической активности, строения частиц и «колоний», устойчивости против неблагоприятных воздействий и другие свойств. Б. играют большую роль в изменчивости и эволюции микробов, причём механизмы воздействия их на клетку разные (см. Трансдукция). Бактериофаги могут резко изменять азотфиксирующую способность азотобактера, токсичность и антигенные свойства патогенных бактерий и др.
Морфология и структура
Как и прочие вирусы, во внеклеточной форме бактериофаги являются метаболически инертными частицами. Бактериофаги различаются по химической структуре, типу нуклеиновой кислоты, строению фаговой частицы, морфологии негативных колоний, характеру взаимодействия с микробными клетками.
Для обозначения бактериофагов используются буквы латинского и греческого алфавитов. В частности хорошо изучены фаги кишечной палочки: λ, ϕX174, fd, f2, R17, Т2.
Большинство из фагов относятся к сложным вирусам и состоят из хорошо сформированной икосаэдрической (кубической) головки и хвоста (отростка) различной степени выраженности, иногда имеющего дополнительные структуры.Все структуры отростка имеют белковую природу.Размер фага колеблется от 20 до 200 нм. Средний диаметр головки – от 60 до 100 нм, длина отростка – 100–200 нм.Длина хвоста, как правило,в 2–4 разабольше диаметра головки.
Головка состоит из генетического материала (двух цепочечной или одноцепочечной нуклеиновой кислоты (РНК или ДНК) с ферментом транскрипаза в неактивном состоянии) и капсида (белковой оболочки). Нуклеиновая кислота и капсид вместе образуют нуклеокапсид.
Значение
Строение вирусов на примере бактериофага может нам о многом сказать, особенно для взаимодействия с другой информацией, которой располагает о них человек. Например, они являются, предположительно, самой древней формой вирусных частиц. Количественный анализ указывает нам на то, что их популяция имеет более 1030 частиц.
В природе их можно обнаружить там же, где обитают и бактерии, к которым они могут проявлять чувствительность. Так как рассматриваемые организмы определяются по месту обитания, предпочтениями бактерий, которых они поражают, то, следовательно, лизирующие почвенных бактерий (фаги) будут жить в почве. Чем больше в субстрате содержится микроорганизмов, тем больше там и необходимых фагов.
В действительности каждый бактериофаг воплощает в себе одну из основных элементных единиц генетической подвижности. Используя трансдукцию, они обуславливают возникновение новых генов в наследственном материале бактерии. За секунду может произойти инфицирование около 1024 бактериальных клеток. Такая форма ответа на вопрос о том, какие вирусы называются бактериофагами, открыто показывает нам способы распределения наследственной информации, происходящие между бактериальными организмами из общей среды обитания.
Систематика бактериофагов
Большое количество
выделенных и изученных бактериофагов
определяет необходимость их систематизации.
Классификация вирусов бактерий
претерпевала изменения: основывалась
на характеристике хозяина вируса,
учитывались серологические, морфологические
свойства, а затем строение и физико-химический
состав вириона .
В настоящее время
согласно Международной классификации
и номенклатуре вирусов бактериофаги,
в зависимости от типа нуклеиновой
кислоты разделяют на ДНК- и РНК- содержащие.
По морфологическим
характеристикам ДНК-содержащие фаги
выделены в следующие семейства:
Myoviridae, Siphoviridae, Podoviridae, Lipothrixviridae,
Plasmaviridae, Corticoviridae, Fuselloviridae, Tectiviridae,
Microviridae, Inoviridae Plectovirus и Inoviridae Inovirus.
РНК-содержащие:
Cystoviridae, Leviviridae.
Рис.2
Диагностическая и терапевтическая роль фагов
Фаги могут применяться в качестве диагностических препаратов для установления рода и вида бактерий, выделенных в ходе бактериологических исследования. Однако чаще всего их используют для лечения и профилактики некоторых инфекционных заболеваний (перорально или местно). Активность фага выражают числом частиц фага, содержащихся в 1 мл или 1 таблетке. Лечебное и профилактическое действие фагов основано на их литической активности.
Отличительной чертой бактериофагов как терапевтических средств является почти полное отсутствие у них побочного действия, что позволяет назначать эти препараты различным возрастным группам без каких-либо ограничений, и возможность назначения поливалентных бактериофагов до получения результатов бактериологического исследования. Препараты диагностических бактериофагов вводить категорически запрещается. В настоящее время в России для фаготерапии и фагопрофилактики производятся и используются:
- поливалентный сальмонеллезный бактериофаг;
- моновалентные бактериофаги — брюшнотифозный, дизентерийный, протейный, синегнойный, холерный, стафилококковый, стрептококковый, коли-фаг (кишечной палочки);
- комбинированные препараты поливалентных бактериофагов — колипротейный, пиобактериофаг (включающий стафилококковые, стрептококковые, клебсиеллезные, эшерихиозные, протейные и синегнойные бактериофаги) и др.
Жизненный цикл
Умеренные и вирулентные бактериофаги на начальных этапах взаимодействия с бактериальной клеткой имеют одинаковый цикл.
- Адсорбция бактериофага на фагоспецифических рецепторах клетки.
- Инъекция фаговой нуклеиновой кислоты в клетку хозяина.
- Совместная репликация фаговой и бактериальной нуклеиновой кислоты.
- Деление клетки.
- Далее бактериофаг может развиваться по двум моделям: лизогенный либо литический путь.
- Умеренные бактериофаги после деления клетки находятся в состоянии профага (лизогенный путь).
- Вирулентные бактериофаги развиваются по литической модели:
- Нуклеиновая кислота фага направляет синтез ферментов фага, используя для этого белоксинтезирующий аппарат бактерии. Фаг тем или иным способом инактивирует ДНК и РНК хозяина, а ферменты фага совсем расщепляют её; РНК фага «подчиняет» себе клеточный аппарат синтеза белка.
- Нуклеиновая кислота фага реплицируется и направляет синтез новых белков оболочки. Образуются новые частицы фага в результате спонтанной самосборки белковой оболочки (капсид) вокруг фаговой нуклеиновой кислоты; под контролем РНК фага синтезируется лизоцим.
- Лизис клетки: клетка лопается под воздействием лизоцима; высвобождается около 200—1000 новых фагов; фаги инфицируют другие бактерии.
Бактерии vs. Человечество: глобальное сопротивление
Случайное открытие Флеминга ознаменовало начало новой эры в медицине. Человечество смогло побороть множество смертельных бактериальных заболеваний, которые на протяжении тысячелетий оставались неизлечимыми.
Но наряду с возможностями антибиотиков, Флеминг обнаружил и другое – при недостаточном количестве пенициллина или если его действие было непродолжительным, бактерии приобретали устойчивость к антибиотику. Флеминг об этом рассказывал в своих выступлениях по всему миру и не раз предупреждал, что не стоит использовать пенициллин, пока заболевание не будет диагностировано, а при необходимости применения антибиотика, его нельзя использовать в течение короткого времени и в совсем малых количествах. К сожалению, это предостережение не помогло.
Уже к 1945 году пенициллин стал доступен повсеместно, активно создавались и другие антибиотики. На протяжении последующих десятилетий они применялись практически бесконтрольно. К примеру, одной из проблем стало самолечение антибиотиками среди населения. Причем при самостоятельном выборе антибиотика часто предпочтение отдавалось именно препаратам широкого спектра действия. Антибиотики стали также широко применяться в сельском хозяйстве – до 80% всех антибиотиков в мире используют для лечения скота. Все это ускорило темпы формирования «антибиотикорезистентности» (от английского resist – «сопротивляться») и привело к тому, что многие инфекционные заболевания снова стали неизлечимы.
Легионеллы – патогенные грамотрицательные бактерии
«Все хотят жить, в том числе и микробы, – рассказывает РИА «Новый день» доктор медицинских наук Тамара Перепанова. – Они развивают сопротивляемость. И эта борьба складывается в пользу микроорганизмов. Они вырабатывают новые штаммы быстрее, чем все фармакологии мира разрабатывают новые препараты. И вот уже антибиотик неэффективен». К слову, самый первый антибиотик – пенициллин – практически бесполезен сегодня: у бактерий к нему развилась почти полная устойчивость.
В 2017 году Всемирная организация здравоохранения (ВОЗ) впервые опубликовала список устойчивых к действию антибиотиков «приоритетных патогенов» – 12 видов бактерий, представляющих наибольшую угрозу для здоровья человека. В их числе – Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacteriaceae, Enterococcus faecium, Staphylococcus aureus, Helicobacter pylori, Campylobacter spp., Salmonellae, Neisseria gonorrhoeae, Streptococcus pneumoniae, Haemophilus influenzae, Shigella. За всеми этими названиями – очень серьезные заболевания: сепсис, менингит, пневмония, брюшной тиф, дизентерия и другие.
По данным ВОЗ практически все существующие патогенные для человека бактерии приобретут устойчивость к антибиотикам уже через 10-20 лет. По прогнозам, к 2050 году число жертв бактериальных инфекций возрастет до 10 млн в год. Кстати, с уверенностью можно констатировать, что для любого жителя нашей страны вероятность подцепить бактериальную инфекцию, устойчивую ко всем основным антибиотикам, сейчас гораздо выше, чем заразиться вирусом из Китая.
Строение и химический состав
Схема строения частицы бактериофага Т2 кишечной палочки.
Частицы многих бактериофагов состоят из головки округлой, гексагональной или палочковидной формы диаметром 45—140 нм и отростка толщиной 10—40 и длиной 100—200 нм (рис.). Другие бактериофагм не имеют отростка; одни из них округлы, другие — нитевидны, размером 8х800 нм. Содержимое головки состоит преимущественно из дезоксирибонуклейновой кислоты (ДНК) (длина её нити во много раз превышает размер головки и достигает 60—70 мкм, эта нить плотно скручена в головке) или рибонуклеиновой кислоты (РНК) и небольшого количества (около 3%) белка и некоторых других веществ. Отросток имеет вид полой трубки, окруженной чехлом, содержащим сократительные белки, подобные мышечным. У ряда бактериофагов чехол способен сокращаться, обнажая часть стержня. На конце отростка у многих Б. имеется базальная пластинка с несколькими шиловидными или другие формы выступами. От пластинки отходят тонкие длинные нити, которые способствуют прикреплению фага к бактерии (см. схему). Оболочки головки и отростка состоят из белков. Общее количество белка в частице фага 50—60% , нуклеиновых кислот — 40—50% . Каждый Б. обладает специфическими антигенными свойствами, отличными от антигенов бактерии-хозяина и других фагов. Имеются антигены, общие для ряда фагов (особенно содержащих РНК).
Распространение. Б. найдены для большинства бактерий, в том числе патогенных и сапрофитных, а также .для актиномицетов (актинофаги) и сине-зелёных водорослей. Встречаются Б. в кишечнике человека и животных, в растениях, почве, водоёмах, сточных водах, навозе и т. д. Б. почвенных микроорганизмов влияют на течение микробиологических процессов в почве (денитрификацию, аммонификацию, азотфиксацию).
Жизненный цикл бактериофагов
Фаги как и другие вирусы неподвижны. Взаимодействие вируса с клеткой хозяина начинается после случайного столкновения в среде. Жизненный цикл бактериофагов, которые попали в клетки, может проходить двумя путями, которые существенно отличаются. (соответственно выделяют вирулентных и лизогенных фагов)
Вирулентные фаги
Развитие вирулентных фагов проходит в несколько этапов.
- Адсорбция. Фаги могут развиваться не в любой бактерии, а только на Видоспецифические. Специфичность хозяина и фага обуславливается спецификой адсорбции, которая в свою очередь зависит от рецепторов, которые присутствуют в клеточной стенке хозяина. По степени специфичности выделяют полифаг — способны поражать несколько видов бактерий одного рода, монофаги — поражают бактерий одного вида, типичные фаги — поражают только определенный штамм (тип) бактерий одного вида. Рецепторы могут находиться в липопротеиновыми или в липополисахаридный слое.
- Инъекция (введение нуклеиновой кислоты фага в клетку). При этом у фага Т2 базальная пластинка прикрепляется к клетке, чехол отростка сокращается, а пустой стержень прокалывает клеточную стенку, через него геном вируса попадает в клетку. Пустая белковая оболочка остается снаружи.
- Латентный период. Во время него останавливается синтез ДНК, РНК и белков клетки-хозяина.
- Синтез молекул фага. Начинается синтез фаговой ДНК из разрушенной ДНК хозяина, а также синтез белков вируса.
- Созревание Т-фагов — сложный многоступенчатый процесс, при котором сначала образуются капсиды, полость которых заполнена белками. После растворения этих белков полость заполняется ДНК к определенной плотности, капсиды закупориваются. Затем достраиваются компоненты отростка.
- Выход фагов. Под влиянием фермента лизоцима, синтезированном под контролем ДНК фагов, клеточная стенка бактерии разрушается, фаги выходят наружу и инфицируют другие клетки-хозяина.
Лизогенных фаги
Некоторые фаги поражают клетки-хозяина но не размножаются в них автономно и не влекут лизиса (разрушения) клеток до определенного момента. Такие бактериофаги называют умеренными или лизогенных, их жизненный цикл был изучен на примере фага λ (лямбда) кишечной палочки. При этом нуклеиновая кислота фага попав в клетку, интегрируется в бактериальную хромосому с помощью специфических ферментов. После этого в течение нескольких поколений геном фага реплицируется вместе с геномом бактерии. Информация, содержащаяся в ДНК фага никак не проявляется. Такое состояние может продолжаться неопределенно долго. Но под влиянием некоторых факторов внешней среды ДНК вируса высвобождается из генома бактерии и начинается стадия вирулентного фага с построением вирусных частиц и лизисом клетки-хозяина.
Факт 6: Бактериофаги используются для борьбы с вредоносными бактериями
Ученые выделили бактериофагов, которые разрушают клостридиум диффициле, влияющих на пищеварительную систему, вызывая диарею и колит. Лечение этого типа инфекций бактериофагами дает возможность сохранить хорошие кишечные бактерии, уничтожая только клостридиум диффициле.
Бактериофаги рассматриваются в качестве отличной альтернативы антибиотикам. Из-за чрезмерного употребления антибиотиков устойчивые штаммы бактерий становятся все более распространенными. Бактериофаги также используются для уничтожения других вредоносных бактерий, включая лекарственно-устойчивые кишечную палочку и золотистый стафилококк.
Бактериофаги: виды и назначение
Применение бактериофагов в медицине обширно, чаще всего используются поливалентные виды, которые содержат целый комплекс активных микроорганизмов. Основные формы:
- Колифаги или просто коли – помогают справиться с кожными воспалениями и инфицированием внутренних органов, вызванных энтеропатогенными кишечными палочками.
- Брюшнотифозные бактериофаги – устраняют недуги, вызванные сальмонеллой и возбудителями брюшного тифа.
- Колипротейные или колипротеофаги – применяются в лечении циститов, кольпитов, пиелонефритов, колитов и других заболеваний, вызванных энтеропатогенными бактериями эшерихий и вирусом протея.
- Клебсиеллезные поливалентные бактериофаги — это комплексное средство, уничтожающее клебсиеллы риносклеромы, пневмонии и озена.
- Дизентерийные поливалентные дизфаги – уничтожают шигеллы Флекснера и Зонне при бактериальных дизентериях.
- Протейный протеофаг – борется с протейными видами специфических микроорганизмов, наподобие вульгариса и мирабилиса, которые являются основной причиной появления гнойных воспалений кишечника.
- Стафилофаги – уничтожают действие стафилококковых микробов, активных при любом гнойном воспалении.
- Клебсиеллы пневмонии, клебсифаги – лечат воспалительные недуги пищеварительной, урогенитальной и дыхательной системы, вызванных клебсиеллами пневмонии.
- Стрептофаг – активно борется с воспалительными инфекциями, вызванные стрептококком.
- Синегнойный – применяется в лечении дисбактериоза, и других инфекций, вызванных синегнойной палочкой.
Классификация бактериофагов
На сегодняшний день насчитывается 19 видов активных форм вирусов. Различаются они по форме, своему строению генома и типу нуклеиновой кислоты. Классификация этих препаратов в медицине различается и по скорости их влияния на активность микроорганизмов:
- умеренные – лишь частично поражают и разрушают болезнетворные бактерии, но вызывают в них существенные изменения, которые передаются при дальнейшем их размножении, не допуская прогрессии вируса;
- вирулентными принято называть те, что попадая в организм, действуют стремительно и очень активно и практически моментально разрушая клетки бактерий, приводя их к гибели.