Особенности и описание острого миелобластного лейкоза у взрослых
Содержание:
Этиология и патогенез
Этиология и патогенез соответствуют таковым для всех гематобластозов. В своем развитии болезнь последовательно проходит моноклоновую (доброкачественную) и поликлоновую (злокачественную) стадии. Причем безграничная опухолевая прогрессия развивается преимущественно в гранулоцитарном ростке кроветворения, а иногда (редко) сочетается с увеличенной генерацией мегакариоцитов.
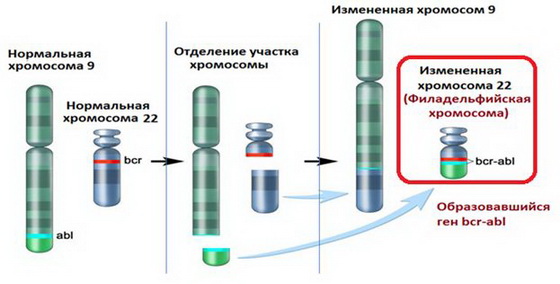
У большинства больных (95%) в клетках-предшественницах гранулопоэза, в гранулоцитах, моноцитах, а также эритрокариоцитах и мегакариоцитах выявляется аномальная филадельфийская хромосома (Ph-хромосома), несущая реципрокную транслокацию t(9;22). Характерным является ее отсутствие в лимфоцитах.
На примере хронического миелоидного лейкоза впервые была показана связь злокачественного заболевания с конкретной генетической аномалией. В случае данного заболевания такой характерной аномалией является хромосомная транслокация, которая проявляется присутствием в кариотипе так называемой филадельфийской хромосомы, которая была описана исследователями П.Ноуеллом (Пенсильванский университет) и Д.Хангерфордом (Онкологический центр Фокса Чейза) в 1960 году в Филадельфии (штат Пенсильвания, США).
При этой транслокации, участки 9-й и 22-й хромосом меняются местами. В результате, фрагмент гена BCR из хромосомы 22 и ген ABL из хромосомы 9 объединяются в аномальный слитый ген BCR-ABL. Продуктами этого аномального слитого гена могут быть белки с молекулярной массой 210 (p210) или, реже, 185 кДа (p185). Так как в норме белок ABL содержит тирозинкиназный домен и управляет выработкой фермента тирозинкиназы, то продукт мутантного гена также является тирозинкиназой, но неправильной.
Белок BCR-ABL взаимодействует с одной из субъединиц клеточного рецептора к интерлейкину 3. Транскрипция гена BCR-ABL происходит непрерывно и не нуждается в активации другими белками. BCR-ABL активирует сигнальный каскад, контролирующий клеточный цикл, ускоряя деление клеток. Более того, белок BCR-ABL подавляет репарацию ДНК, вызывая неустойчивость генома и делая клетку более восприимчивой к дальнейшим генетическим аномалиям.
Активность BCR-ABL — патофизиологическая причина хронического миелолейкоза. Продукция BCR-ABL-зависимой тирозинкиназы играет ключевую роль в лейкозном перерождении клеток. Постоянная высокая тирозинкиназная активность приводит к безудержному размножению клеток, блокированию их запрограммированного старения и гибели, увеличению выхода лейкозных клеток из костного мозга в кровь.
По мере изучения природы белка BCR-ABL и его тирозинкиназной активности, была разработана таргетная (целевая) терапия, позволяющая специфически ингибировать эту активность. Ингибиторы тирозинкиназ могут способствовать полной ремиссии болезни, что ещё раз подтверждает ведущую роль BCR-ABL в развитии заболевания
В отличие от острого миелоидного лейкоза, при хроническом миелоидном лейкозе образуются зрелые белые кровяные клетки и тромбоциты, которые полностью выполняют свои функции
Это важное отличие от острого лейкоза объясняет менее тяжелое начальное течение хронического миелоидного лейкоза
Непосредственная причина, вызывающая транслокацию BCR-ABL, практически не известна. Влияние каких-либо вредных экологических факторов, наследственности или пищевых веществ на повышение частоты заболевания не выявлено.
У части пациентов причиной такой мутации является воздействие очень высоких доз радиации. Этот эффект наиболее подробно изучен у японцев, переживших ядерную бомбардировку в период Второй мировой войны. У выживших людей после ядерной бомбардировки было выявлено повышение частоты заболевания в 30–50 раз, причем пик заболеваемости отмечался в сроки от 5 до 12 лет после лучевого воздействия. Небольшое повышение риска имеет место также у некоторых пациентов, получивших высокие дозы лучевой терапии для лечения других видов рака.
Предполагается, что в большинстве случаев причиной хронического миелоидного лейкоза может являться внутренняя генетическая нестабильность.
Причины развития болезни
Определенные гены контролируют рост и деление клеток. Одни стимулируют процесс развития (онкогены), другие замедляют его, вызывая физиологическую смерть клетки (супрессоры). Миелоидный лейкоз провоцируют мутации ДНК, способствующие распространению онкогенов или «отключению» супрессоров.
В клетках человеческого организма содержится по 23 пары хромосом. Обычно ХМЛ начинает развиваться при «обмене» фрагментов между 9 и 22 хромосомами (транслокация). Образуется аномальный ген, а 22 хромосома уменьшается в размерах. Трансформированная хромосома, названная филадельфийской, наблюдается в измененных клетках почти всех пациентов с диагнозом «хронический миелолейкоз». Именно она вызывает рост и хаотичное деление патологических клеток.
У незначительного числа больных вредоносные клетки измененной хромосомы не содержат. Считается, что у них пораженный ген образуется иначе. Крайне редко у пациентов не наблюдается ни измененного гена, ни «поломанной» хромосомы. Предполагается, что в этом случае развитие провоцируют неизвестные онкогены.
Дефект хромосомы специалисты не относят к генетическим, но исследования показали: велика вероятность развития патологии у детей, один из родителей которых имеет какие-либо генетические отклонения (синдром Дауна). На возникновение хронического миелоидного лейкоза влияют определенные внешние факторы:
- высокие дозы радиационного облучения;
- негативное воздействие химических веществ (спирты, эпоксидные смолы, алкены, кетоны, альдегиды);
- возраст (более 30 лет);
- пол (чаще заболевание диагностируют у мужчин).
Фактором риска может выступить ослабленный иммунитет. Курение способствует более тяжелому протеканию заболевания.

Симптомы и причины
Симптомы заболевания проявляются в первые пару месяцев. Это происходит потому, что поражённые лейкозом клетки начинают размножаться, подавляя функцию миелоидной ткани производить здоровые эритроциты, лейкоциты и тромбоциты. Специфических симптомов миелоидная лейкемия не имеет. Они напрямую зависят от того, в каких клетках происходят мутации, насколько сами лейкоциты дозревшие, и от множества других факторов.
Недостаток лейкоцитов приводит к снижению иммунитета. Больные становятся восприимчивыми к различным заболеваниям, простудным, например. Больные клетки, несмотря на то, что сами происходят от лейкоцитов, неспособны противостоять инфекциям, и функция защиты организма у них отсутствует. Симптомы дефицита лейкоцитов могут напоминать признаки гриппа или другого простудного заболевания.
Когда при миелоидном лейкозе снижено количество тромбоцитов, у больных отмечается плохая свёртываемость крови. Кожа таких пациентов легко повреждается, а кровотечения тяжело остановить. О роли тромбоцитов в организме мы писали выше. Могут наблюдаться кровотечения слизистых оболочек. На теле часто появляются синяки и кровоподтёки без сильного нажатия
Поражение эритроцитов (красных кровяных телец) проявляется анемией. Это бледность кожи, быстрая утомляемость (также один из основных симптомов для всех типов болезни) и отдышка.
Общими симптомами могут быть потеря веса, повышенная температура, озноб. Петехии – крошечные пятнышки, которые проявляются на месте кровоизлияний, склонность к образованию гематом, даже при небольшом нажатии на кожу.
Когда на первых этапах больные клетки начинают накапливаться в костном мозге, то у пациентов наблюдаются сильные боли и ломота в руках и ногах. Людям больно ходить и совершать другую физическую активность.
Симптомы добавляются, когда раковые клетки начинают проникать в другие органы. Чаще всего это лимфатические узлы, печень, селезёнка, то есть те, которые непосредственно работают с кровью. Они нарушают их нормальную функцию, и поражённый орган начинает отекать. Абсолютно никакие органы не защищены от заболевания. Лейкозные клетки могут проникать также в головной мозг. Пациенты жалуются на головную боль, может возникнуть воспаление или паралич лицевого нерва.
Причины ОМЛ у детей и взрослых
Первопричины заболевания острым миелоидным лейкозом как у детей, так и у в взрослых плохо изучены. Но есть ряд способствующих факторов, при которых риск заболеть лейкозом возрастает.
Предлейкозные нарушения крови или миелодиспластический синдром характеризуются дефицитом в крови одной или нескольких клеток (тромбоцитов, эритроцитов и др.), дисплазией (изменением тканей) красного вещества. Делится на различные подтипы, в зависимости от вида недостающей клетки.
Высок риск заболеть, после различных видов химиотерапии, особенно в первые 5 лет после приёма препаратов.
Непосредственный контакт с различными химическими веществами, например, с бензолом (его роль в развитии лейкоза оспаривается) и другими растворителями, которые относят к группе канцерогенов.
Канцерогены – вещества различного воздействия, повышающие риски развития злокачественных опухолей. Подобные свойства могут иметь вещества различной природы: химические, излучение, ультрафиолет, бактерии или онкогенные вирусы. Медики подсчитали, что 80 – 90% всех онкозаболеваний возникали под действием таких факторов.
Канцерогены в продуктах
Воздействие радиоактивного излучения – также повышает риск развития лейкоза. Доказано, что после ядерного удара в Хиросиме и Нагасаки и аварии на Чернобыльской АЕС количество заболеваний возросло из-за разрушения радиоактивным излучением белых кровяных телец.
Что касается генетической предрасположенности, например, у пациентов с синдромом Дауна риск заболеть миелобластным лейкозом выше в 10 раз
Наследственная предрасположенность не доказана. Есть сообщения о том, что заболеваемость среди родственников превышает среднестатистическую, но наследственность воспринимается как косвенный фактор заболевания.
Хронический миелолейкоз
– распространённой вид лейкоза, на его долю приходится около 20% всех лейкозов. В странах Европы и Северной Америки ХМЛ занимает 3-е место по частоте после острых лейкозов и хронического лимфолейкоза. Ежегодная заболеваемость составляет 1-1,5 случая на 100000 населения. Пик заболеваемости приходится на возраст 30-50 лет, около 30% составляют больные старше 60 лет.
ХМЛ возникает вследствие соматической мутации в гемопоэтической стволовой клетке, результатом которой является уникальная цитогенетическая поломка — транслокация t(9;22)(q34;q11) с удлинением длинного плеча одной из хромосом 9 и укорочением одной из хромосом 22. Укороченная хромосома 22 называется филадельфийской и обозначается как Ph-хромосома. Для установления диагноза ХМЛ обязательным диагностическим методом является цитогенетическое исследование крови и/или костного мозга.
В течении ХМЛ выделяют три фазы: 1. хроническую, 2. продвинутую, или фазу акселерации, 3. острую, или терминальную (бластный криз). Продолжительность фаз болезни у разных пациентов различается, ХМЛ может быть впервые диагностирована в любой из них.
Хроническая фаза характеризуется постепенно нарастающим лейкоцитозом – 15-20 х109/л в начале заболевания, иногда до 500-900 х109/л и более при развернутой клинической картине. Одновременно в крови появляются незрелые гранулоциты: миелоциты, метамиелоциты, иногда – промиелоциты, даже единичные бластные клетки. Характерно увеличение числа базофилов до 5-10% и нередко одновременно эозинофилов – эозинофильно-базофильная ассоциация. В большинстве случаев отмечается увеличение количества тромбоцитов. В начале заболевание может протекать почти бессимптомно, через несколько месяцев при осмотре обнаруживается увеличение селезенки, которая без лечения достигает огромных размеров. В таких случаях в ней часто бывают инфаркты, которые сопровождаются выраженным болевым синдромом (острой болью). При выраженной спленомегалии может быть увеличена печень.
Терминальная фаза у 80-85% больных характеризуется развитием бластного криза – появление в крови и костном мозге более 20% бластных клеток. Число лейкоцитов при этом может и не повышаться по сравнению с предыдущей фазой. Как правило, в этой фазе развивается не отмечавшаяся на предыдущих этапах анемия, зачастую одновременно и тромбоцитопения. У большинства больных появляются жалобы на повышение температуры тела, ноющую боль в костях, быстрое увеличение селезенки в размерах.
Цель современной терапии ХМЛ – максимальное подавление Ph-позитивного опухолевого клона. Стандартом в настоящее время является терапия ингибиторами BCR-ABL-тирозинкиназ (ИТК). Препараты из группы ИТК обладают механизмом таргетного действия на Ph-позитивные лейкемические клетки. В настоящее время в клинической практике доступны несколько препаратов (иматиниб, дазатиниб, нилотиниб). Для каждого конкретного пациента терапия может быть выбрана с учетом наибольшей эффективности и наименьшей токсичности. Терапия одним из ингибиторов тирозинкиназ должна быть начата сразу после подтверждения диагноза ХМЛ. Лечение может проводиться в амбулаторных условиях. Прием ИТК можно начинать при любом числе лейкоцитов. После начала приема ИТК число лейкоцитов начинает снижаться через 1-2 недели и нормализуется к 4-6 неделям. Уменьшение повышенного числа тромбоцитов обычно отстает на 1-2 недели. При лечении больных в хронической фазе ХМЛ при снижении числа гранулоцитов менее 1,0х109/л или тромбоцитов менее 50х109/л рекомендуется сделать перерыв в лечении и возобновить его при увеличении количества гранулоцитов до 1,5х109/л, тромбоцитов до 100х109/л.
Для правильной оценки эффективности терапии ингибиторами тирозинкиназ рекомендуется цитогенетическое исследование каждые 6 мес. После достижения полной цитогенетической ремиссии рекомендуется на протяжении всего заболевания каждые 3 мес. проводить молекулярное исследование на наличие BCR-ABL-транскрипта с помощью ПЦР в реальном времени.
Разновидности
Миелоидный лейкоз подразделяется на две формы: острую и хроническую. Формы миелолейкоза не могут переходить из острой в хроническую. Это разные заболевания с особенными типичными признаками. Для острого миелобластного лейкоза типично чрезмерное размножение и рост незрелых бластных клеток. ОМЛ очень тяжёлое и трудно поддающееся лечению заболевание. При остром миелобластном лейкозе развитие болезни происходит стремительно, что требует своевременного лечения.
У этого заболевания три стадии развития:
- начальная – чаще всего проходит незамеченной. При лабораторных исследованиях наблюдаются изменения в биохимии крови. У больного развиваются бактериальные инфекции, обостряются хронические заболевания;
- развёрнутая – проявляются признаки заболевания. Иногда чередуются обострения и стадии ремиссии. Очень часто наступает полная ремиссия. Если выздоровление не наступило, происходит обострение заболевания и переход в терминальную стадию;
- терминальная – характеризуется широкомасштабным нарушением процесса здорового кроветворения.
Острый миелоидный (или миелобластный) лейкоз может развиваться у людей любого возраста, но чаще всего он встречается у пациентов старше 50 лет. Это один из распространённых видов рака крови у детей и подростков. В детской онкологии миелолейкозы стоят на втором месте, уступая лишь острому лимфолейкозу. У детей это заболевание встречается почти в 25% случаев.
Миеломоноцитарный (миеломонобластный) лейкоз – это форма миелолейкоза, когда поражаются клетки красного костного мозга в крови: монобласты и миелобласты. В бластах отсутствуют тельца Ауэра – красные белковые клетки в цитоплазме миелоцитов и миелобластов. Миеломоноцитарный лейкоз имеет три клинических типа: острый, хронический и ювенильный.
Для хронического миелолейкоза характерно чрезмерное аномальное образование и рост зрелых и созревающих лейкоцитов. Болезнь развивается медленно и не имеет заметных симптомов на ранних стадиях. Очень часто обнаруживается случайно при лабораторном анализе крови по поводу других заболеваний.
Хронический лейкоз также имеет три стадии развития:
- доброкачественная – протекает в течение длительного времени бессимптомно, выражается неуклонным повышением количества лейкоцитов в крови;
- развёрнутая – проявляются клинические признаки болезни, уровень лейкоцитов растёт;
- терминальная – здоровье пациента резко ухудшается. Отмечается низкая чувствительность к назначенному лечению, развиваются инфекционные осложнения.
Хроническая форма миелоидной лейкемии чаще всего бывает у взрослых людей, но у детей тоже встречается (около 2% случаев). К группе хронических миелоидных лейкозов относятся: хроническая форма моноцитарного рака крови, сублейкемический миелоз, эритромиелоз и другие подобные лейкозы.
Сублейкемический тип хронического миелолейкоза чаще всего встречается у пациентов пожилого возраста. Заболевание сопровождает разрастание соединительных тканей костного мозга и их замещение рубцовыми соединительными тканями. Отличительной чертой этого вида лейкоза является отсутствие симптомов и жалоб со стороны пациента в течение длительного времени. Также встречаются хронические миелоцитарные лейкозы – группа заболеваний, при которых образуются опухолевые клетки типа цитарных или процитарных предшественников миелоидного ряда.
Систематизация ОМЛ по версии ВОЗ разделяет несколько десятков видов болезни на несколько групп:
- ОМЛ с типичными генными изменениями;
- ОМЛ с нарушениями, связанными с дисплазией;
- вторичные ОМЛ, начинающиеся в результате терапии других болезней;
- заболевания с пролиферацией миелоидного ростка при синдроме Дауна;
- миелоидные саркомы (миелосаркомы);
- бластные плазмоцитоидные дендритноклеточные опухоли;
- другие разновидности ОМЛ.
Согласно FAB классификации также существует несколько вариантов острых миелоидных лейкозов:
- M0 – недифференцированный ОМЛ;
- M1 – ОМЛ без созревания клеток;
- M2 – ОМЛ с неполным созреванием клеток;
- M3 – промиелоцитарный лейкоз;
- M4 – миеломоноцитарный лейкоз;
- M5 (M5a и M5b) – монобластный лейкоз;
- M6 – эритролейкоз;
- M7 – мегакариобластный лейкоз.
Как проводится диагностика?
Чтобы поставить правильный диагноз, необходимо правильно оценить:
- развернутый анализ крови (опытный врач-лаборант умеет отличать клетки-предшественники от нормальных, подсчет лейкоцитарной формулы выявит рост бластов и недозревших клонов);
- уменьшение численности эритроцитов и тромбоцитов указывает на их подавление бластными клетками;
- биохимические тесты на белок, билирубин, ферменты подтверждают мнение о нарушении работы печени и селезенки;
- исследование костного мозга из бедренной кости позволяет не только выяснить направление перерождения кроветворения, но и провести генетический анализ на филадельфийскую хромосому.
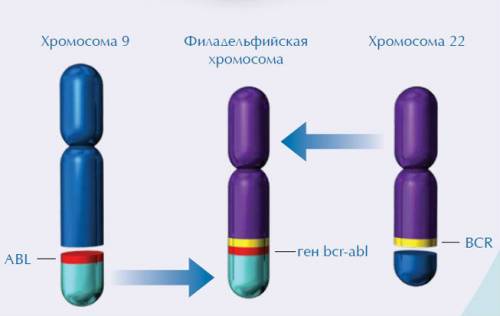 С целью исследования хромосомных аномалий применяют способ полимеразной цепной реакции, филадельфийская хромосома является специфическим маркером миелоидного лейкоза
С целью исследования хромосомных аномалий применяют способ полимеразной цепной реакции, филадельфийская хромосома является специфическим маркером миелоидного лейкоза
Дополнительно могут потребоваться:
- УЗИ печени и селезенки;
- магнитно-резонансная или компьютерная томография для исключения тромбоза венозной системы внутренних органов.
Терапия патологии
Терапия хронического миелолейкоза определяется стадией патологии. На ранней стадии рекомендовано общеукрепляющее лечение, сбалансированное, обогащенное витаминами питание, регулярный диспансерный контроль. В остальных случаях при ХМЛ применяют медикаментозные средства, способствующие уменьшению величины селезенки и понижению активности злокачественных клеток. От адекватности и своевременности проводимой терапии напрямую зависит продолжительность жизни больного. Терапия осуществляется несколькими методами:
- Медикаментозное лечение (Цитозар, Альфа-интерферон, Миелосан);
- Трансплантация костного мозга (вероятность выздоровления выше при операции на ранних стадиях течения патологии, предпочтительные доноры – родственники пациента);
- Лучевая терапия (цель – уничтожение злокачественных клеток, сокращение темпов их развития);
- Удаление селезенки (обычно на последней стадии развития патологии). Показаниями к хирургическому вмешательству могут служить тромбоцитопения, угроза повреждения селезенки, явный дискомфорт, вызванный размерами органа.
Если прием лекарственных препаратов не дает ожидаемого эффекта, применяют лейкофорез – клеточное очищение крови от чрезмерного количества лейкоцитов. Иногда его применяют параллельно с медикаментозным лечением. На значительно увеличенную селезенку иногда воздействуют рентгеновскими лучами, это способствует уменьшению ее величины. При возникновении гнойных воспалительных очагов применяют антибиотики.
При развитии выраженной анемии, толерантной к цитостатикам, или при терапии железодефицитной анемии соответствующими препаратами железа показано переливание крови. Пациенты подлежат постановке на диспансерный учет, им необходимы регулярные осмотры и наблюдение за показателями крови. Самостоятельная терапия хронической формы миелоидного лейкоза несостоятельна и недопустима.
Прогрессирование патологии
При развитии патологии показаны цитостатики. Масштабность проводимого лечения зависит от фазы заболевания. Возникновение явных симптомов (увеличение органов, рост числа лейкоцитов в сравнении с более ранней стадией патологии) – повод для применения первично-сдерживающих подходов. Пациентам в небольших дозах амбулаторно прописывают гидроксимочевину – при условии контроля показателей крови. После ремиссии заболевания применяют поддерживающее лечение.
Развернутая стадия патологии
Если заболевание перешло в развернутую стадию, медикаментозное лечение проводят в зависимости от «группы риска» (гематологические показатели). При незначительных рисках изначально осуществляют лечение одним препаратом (монохимиотерапия), при высоком сразу рекомендуется применять несколько лекарственных средств одновременно (полихимиотерапия).
Завершив курс монохимиотерапии, сначала назначают то же средство, но в большей дозировке. При улучшении показателей крови его отменяют или снижают дозировку. Если применявшийся цитостатик не принес ожидаемого эффекта в течение месяца, осуществляют лечение другим лекарственным препаратом.
После курса химиотерапии проводят поддерживающее лечение (схема схожа со схемой первично-сдерживающей терапии). Используют лекарственные средства, оказавшиеся эффективными при курсовом лечении. Полихимиотерапию осуществляют при повышенной степени риска и на последней стадии ХМЛ. При бластном кризе терапия схожа с лечением острой лейкемии. Полихимиотерапию проводят короткими курсами по 5-14 дней. Продолжительность перерывов составляет 7-10 дней.
Альфа-интерферон
К принципиально новым средствам терапии хронического миелолейкоза относят альфа-интерферон – антагонист факторов роста. Он тормозит влияние мегакариоцитов на процесс кроветворения и препятствует размножению гранулоцитов. Помимо этого, альфа-интерферон активизирует противоопухолевый иммунитет, создавая условия для нормализации кроветворения.
Являясь цитостатиком, лекарственное средство не оказывает депрессивного воздействия на здоровые клетки. Лечение альфа-интерфероном может вызвать и цитогенетическую ремиссию – отсутствие филадельфийской хромосомы. Это говорит даже не о ремиссии, а о полном выздоровлении пациента.
Мер профилактики хронического миелолейкоза не существует. Возможно только предупреждение обострений патологии (поддерживающее лечение, предотвращение инсоляции, простудных болезней). Средняя продолжительность жизни при ХМЛ – три-пять лет, иногда – до восьми. После развития бластного криза больному редко удается прожить больше года.
Лечение недуга
Лечение хронического миелоидного лейкоза не требует госпитализации и может проводиться в амбулаторных условиях. Терапия назначается сразу, после установления диагноза. При хронической фазе основным заданием терапии есть снижение уровня лейкоцитов.
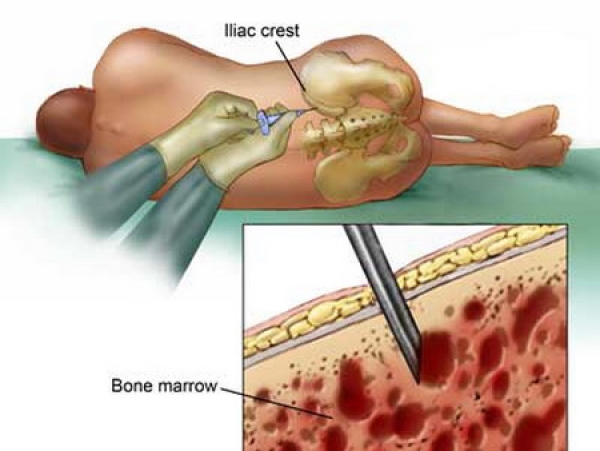
Процедура пересадки стволовых клеток, как один из методов лечения болезни
Лечение данного заболевания возможно путем:
- пересадки стволовых клеток;
- химиотерапии;
- симптоматической терапии.
Первый курс лечения предполагает прохождение химиотерапии, что позволяет уничтожить пораженные патологией раковые клетки. Курс химиотерапии не является гарантией полного излечения. Трансплантация костного мозга позволяет говорить о полном выздоровлении, но ремиссия может длиться достаточно длительный период. Химиотерапия является единственным методом лечения если:
- из-за физического состояния противопоказана лучевая терапия;
- больной отказывается подвергать себя высокому риску;
- невозможно найти донора.
Химиотерапия кроме пораженных клеток разрушает и клеток костного мозга. Пересадка донорских клеток является очень эффективной методикой лечения. Производится отбор и заморозка клеток. При благополучной пересадке клетки начинают приживаться в организме. Далее идет их созревание и развитие. Из них получаются полноценные элементы крови. Существуют 2 способа пересадки клеток: в одном из них используют донорские клетки, в другом – самого пациента.
Важно! Острый миелоидный лейкоз стремительно развивается, поэтому важно своевременно ставить правильный диагноз и назначать адекватное лечение.
Для данного вида болезни не существует промежуточных стадий. Различают вновь установленный диагноз, или заболевание на стадии ремиссии.

Важно помнить, что регулярное обращение к специалистам и осмотры помогут предотвратить недуг
Лечение состоит из двух фаз:
- фаза индукции: назначается терапия, направленная на уничтожение как можно большего количества пораженных клеток, что приводит к ремиссии;
- фаза постремиссии направлена поддержание положительного терапевтического эффекта.
Как в случае с хронической формой, лечение миелоидного вида проводится с использованием, следующих методов:
- химиотерапия;
- назначается курс лучевой терапии;
- проводится симптоматическое лечение;
- пересадка стволовых клеток.
Хронический миелолейкоз
Хроническую форму миелолейкоза характеризует ускоренное и нерегулируемое размножение миелоидных клеток костного мозга, которые быстро накапливаются в кровеносном русле. Как и ОМЛ, хронический миелоидный лейкоз имеет несколько видов, которые определяют дальнейшую тактику лечения:
- наличие филадельийской хромосомы;
- ювенильная форма;
- нейтрофильная или эозинофильная форма;
- первичный миелофиброз.
Причины и отличия от острого
Среди причин развития хронического миелолейкоза выделяют те же факторы, что и при ОМЛ:
- радиоактивное или ионизирующее излучение;
- использование препаратов из ряда цитостатиков;
- наследственная предрасположенность к заболеванию.
Выделяют несколько отличительных черт, которые позволяют дифференцировать хроническую форму заболевания от острого миелолейкоза. Обычно клетки костного мозга при ХМЛ успевают созреть, но большинство из них не в состоянии корректно выполнять свои главные функции. В крови наблюдается значительное уменьшение количества эритроцитов, много белых кровяных телец, однако выполнять свое предназначение они неспособны.
По этой причине развивается недостаточность органов или систем, так как ткани не получают достаточное количество кислорода. Кроме того, организм не может самостоятельно и эффективно бороться с вирусными и бактериальными инфекциями, так как костный мозг не регулирует достаточный синтез антител.
Клиника
На долю ХМЛ от числа всех лейкозов приходится всего до 14% зарегистрированных случаев. Чаще всего болезнь появляется у мужчин в преклонном возрасте, но может быть выявлена и у детей. Клиника хронического миелолейкоза выражена значительно менее, чем острого. Заболевание протекает медленно – пик развития наступает примерно через 2-3 года после начала.
Основные ХМЛ симптомы:
- общая слабость, потеря работоспособности;
- повышение температуры тела;
- увеличение селезенки и печени.
Кроме того, иногда ремиссия отмечается сразу после непродолжительного лечения. При этом подобные периоды облегчения достаточно быстро сменяются рецидивами без назначения определенного лечения.
Очень важно правильно поставить дифференциальный диагноз, чтобы лечение было адекватным заболеванию. Если его не удается взять под контроль, оно достаточно быстро переходит на терминальную стадию
Конечная стадия ХМЛ в большинстве случаев заканчивается смертью пациента, несмотря на проводимую терапию.
Лечение хронического миелоидного лейкоза
Главное направление терапии – использование высокоэффективных лекарственных препаратов цитостатического ряда, назначение которых зависит от стадии заболевания. Средства оказывают непосредственное действие на раковые клетки, останавливая их деление и рост опухоли.
Кроме цитостатиков, назначается лучевая терапия, пересадка здорового костного мозга, многочисленные переливания крови с функционирующими кровяными тельцами. Такие методы лечения используют при недостаточной эффективности консервативной медикаментозной терапии или для поддержки действия препаратов.
Прогноз для жизни
Обычно хроническая форма миелолейкоза не поддается лечению, и большинство пациентов погибает на терминальной стадии болезни. Продолжительность жизни людей, у которых был диагностирован хронический миелоидный лейкоз, составляет 1,5-2 года. При терминальной стадии пациенты погибают через 3-4 месяца после бластного криза.
Медицинские новости
Специалисты заявляют о нестабильной эпидемиологической ситуации по заболеваемости коклюшем в различных регионах РФ – в том числе, и в Санкт-Петербурге. По данным Федеральной службы по надзору…
Мигрень широко распространена во всем мире, изучена лучше других типов головной боли и является второй ведущей причиной потерянных лет жизни . На сегодняшний день в России от этого заболевания страдают более 20 миллионов человек. При этом большинство из них не знают о своем диагнозе…
Фотовыставка «Видеть главное», посвященная пациентам с псориазом, открылась на портале МБОО «Кожные и аллергические болезни» в виртуальном формате. «Видеть главное» — это 12 портретов, выполненных в технике стерео-варио, которая позволяет увидеть фото со следами псориаза и без них в зависимости от того, под каким углом смотрит посетитель.
Статистика показывает, что ишемическая болезнь сердца и инсульт уносят больше всего человеческих жизней во всем мире. Коронавирус COVID-19 — серьезное явление, но про здоровье других органов в тоже время забывать не стоит. На здоровье сердца влияет не так много факторов…
Александровскую больницу закрыли на карантин по постановлению главного санитарного врача Санкт-Петербурга. Это связано с тем, что в этой больнице умер 55-летний пациент с подтвержденным коронавирусом Covid-2019
Причины развития заболевания
Хронический миелоидный лейкоз, как и причины, провоцирующее нарушение, изучены недостаточно хорошо.
Специалисты провоцирующих факторов называют такое:
- действие радиации в небольших количествах;
- прием лекарственных препаратов, цитостатиков;
- влияние химических веществ, электромагнитного излучения и вирусов;
- наследственные нарушения хромосомного характера.
На фоне нарушений хромосомного состава в клетках, из которых составлен красный костный мозг, формируется новая ДНК, отличающаяся не характерной структурой. Потом злокачественные клетки заменяют нормальные.
Они попадают в кровь, не успевая трансформироваться в полноценные лейкоциты. В этом случае лейкоциты перестают выполнять свои обязанности.