Важность процесса гемопоэза и схема гемопоэза в жизни человека
Содержание:
Воздействие на здоровье
Некоторые заболевания крови могут влиять на здоровые кровяные клетки в крови, даже если происходит кроветворение.
Например, рак лейкемии и лимфомы может изменить количество белых кровяных телец в кровотоке. Опухоли в кроветворной ткани, вырабатывающей кровяные клетки, такие как костный мозг, могут влиять на количество клеток крови.
Процесс старения может увеличить количество жира в костном мозге. Это увеличение жира может затруднить выработку клеток крови костным мозгом. Если организм нуждается в дополнительных клетках крови из-за болезни, костный мозг не в состоянии опережать этот спрос. Это может вызвать анемию, которая возникает, когда в крови отсутствует гемоглобин из красных кровяных телец.
Гемопоэз — это постоянный процесс, в результате которого образуется огромное количество клеток. Оценки варьируются, и точное число камер зависит от индивидуальных потребностей. Но в обычный день организм может вырабатывать 200 миллиардов эритроцитов, 10 миллионов лейкоцитов и 400 миллиардов тромбоцитов.
Эмбриональное кроветворение.
Кроветворение во внутриутробном периоде
развития начинается рано. По мере роста
эмбриона и плода последовательно
меняется локализация гемопоэза в
различных органах.
Табл. 1. Развитие гемопоэтической системы
человека
(по Н.С. Кисляк, Р.В. Ленской, 1978).
|
Локализация кроветворения |
Период эмбриогенеза (недели) |
|
Желточный мешок |
3 – 4 |
|
Начало кроветворения в печени |
5 – 6 |
|
Появление больших лимфоцитов в тимусе |
9 – 10 |
|
Начало гемопоэза в селезенке |
Конец 12-й |
|
Появление гемопоэтических очагов в |
13 – 14 |
|
Лимфопоэз в лимфоузлах |
16 – 17 |
|
Появление циркулирующих малых |
17 |
|
Начало лимфопоэза в селезенке |
20 |
Начинается кроветворение в желточном
мешке на 3-й неделе развития человеческого
эмбриона. В начале оно сводится в основном
к эритропоэзу. Образование первичных
эритробластов (мегалобласты) происходит
внутри сосудов желточного мешка.
На 4-й неделе кроветворение появляется
в органах эмбриона. Из желточного мешка
гемопоэз перемещается в печень, которая
к 5-й недели гестации становится центром
кроветворения. С этого времени наряду
с эритроидными клетками начинают
образовываться первые гранулоциты и
мегакариоциты, при этом мегалобластический
тип кроветворения сменяется на
нормобластический. К 18-20-й неделе развития
человеческого плода кроветворная
активность в печени резко снижена, а к
концу внутриутробной жизни, как правило,
совсем прекращается.
В селезенке кроветворение начинается
с 12-й недели, образуются эритроциты,
гранулоциты, мегакариоциты. С 20-й недели
миелопоэз в селезенке сменяется
интенсивным лимфопоэзом.
Первые лимфоидные элементы появляются
на 9-10 неделе в строме тимуса, в процессе
их дифференцировки образуются
иммунокомпетентные клетки – Т-лимфоциты.
К 20-й неделе тимус по соотношению малых
и средних лимфоцитов сходен с тимусом
доношенного ребенка, к этому времени в
сыворотке крови плода начинают
обнаруживаться иммуноглобулины М и G.
Костный мозг закладывается в конце 3-го
месяца эмбрионального развития за счет
мезенхимальных периваскулярных
элементов, проникающих вместе с
кровеносными сосудами из периоста в
костномозговую полость. Гемопоэтические
очаги в костном мозге появляются с 13-14
недели внутриутробного развития в
диафизах бедренных и плечевых костей.
К 15-й неделе в этих локусах отмечается
обилие юных форм грануло-, эритро- и
мегакариоцитов. Костномозговое
кроветворение становится основным к
концу внутриутробного развития и на
протяжении всего постнатального периода.
Костный мозг в пренатальном периоде
красный. Его объем с возрастом плода
увеличивается в 2,5 раза и к рождению
составляет порядка 40 мл. и он присутствует
во всех костях. К концу гестации начинают
появляться в костном мозге конечностей
жировые клетки. После рождения в процессе
роста ребенка масса костного мозга
увеличивается и к 20 годам составляет в
среднем 3000 г, но на долю красного костного
мозга будет приходиться порядка 1200 г,
и он будет локализоваться в основном в
плоских костях и телах позвонков,
остальная часть будет замещена желтым
костным мозгом.
Основным отличие состава форменных
элементов крови плода является постоянное
нарастание числа эритроцитов, содержания
гемоглобина, количества лейкоцитов.
Если в первой половине внутриутробного
развития (до 6 месяцев) в крови обнаруживаются
много незрелых элементов (эритробластов,
миелобластов, промиелоцитов и миелоцитов),
то в последующие месяцы в периферической
крови плода содержатся преимущественно
зрелые элементы.
Изменяется и состав гемоглобина. Вначале
(9-12 нед) в мегалобластах находится
примитивный гемоглобин (HbP),
который заменятся фетальным (HbF).
Он становится основной формой в
пренатальном периоде. Хотя с 10-й недели
начинают появляться эритроциты с
гемоглобином взрослого типа (HbA),
доля его до 30 недели составляет лишь
10%. К рождению ребенка фетальный гемоглобин
составляет приблизительно 60%, а взрослый
– 40% всего гемоглобина эритроцитов
периферической крови
Важным физиологическим
свойством примитивного и фетального
гемоглобинов является их более высокое
сродство к кислороду, что имеет важное
значение во внутриутробном периоде для
обеспечения организма плода кислородом,
когда оксигенация крови плода в плаценте
относительно ограничена по сравнению
с оксигенацией крови после рождения в
связи с установлением легочного дыхания
Схема кроветворения. Органы кроветворения
А. И. Ходжкин исследовал и описал 7 пациентов с поражением лимфатических узлов и селезенки. Заболевание получило название «болезнь Ходжкина», что было предложено С. Уилксом в 1865 г. Этиология окончательно не ясна. Некоторые полагают, что лимфогрануломатоз связан с вирусом Эпштейна-Барра. Генез клеток (Рид-Березовского-Штернера), которые патогномоничны для лимфогрануломатоза, не ясен.
Это многоядерные клетки, несущие на своей поверхности антигены, аналогичные лимфоидному ростку и моноцитоидному ростку. Патологическая анатомия: за субстрат лимфогрануломатоза принимается полиморфно-клеточная гранулома, которая состоит из лимфоцитов, ретикулярных клеток, нейтрофилов, эозинофилов, плазматических клеток и фиброзной ткани. Лимфогрануломатозная ткань изначально формируется в отдельные мелкие узелки, расположенные внутри лимфатического узла.
В дальнейшем прогрессируя, она вытесняет нормальную ткань узла и изменяет его рисунок. Гистологическая особенность лимфогрануломы представлена гигантскими клетками Березовского-Штернберга. Это крупные клетки, диаметром 25 мкм и больше (до 80 мкм), которые содержат 2 и более круглых или овальных ядра, часто находятся рядом, что создает впечатление зеркального изображения. Внутриядерный хроматин нежный, равномерно расположенный, ядрышко четкое, крупное, в большинстве случаев эозинофильное.
Клинико-морфологическая классификация приведена в таблице 1.
Таблица 1
Клинико-морфологическая классификация
При прогрессировании заболевания из очагов поражения пропадают лимфоциты, что в результате отражается на смене гистологических вариантов, которые представляют собой фазы развития заболевания.
Наиболее стабильным вариантом является нодулярный склероз.
Тромбоцитопении – группа заболеваний, при которых отмечается снижение количества тромбоцитов вследствие их повышенного потребления или недостаточного образования. Патологическая анатомия.
Основной характеристикой является геморрагический синдром с кровоизлияниями и кровотечениями. Кровоизлияния возникают чаще в коже в виде петехий и экхимозов, реже в слизистых оболочках и еще реже во внутренних органах. Кровотечения могут быть как желудочные, так и легочные. Может иметь место увеличение селезенки в результате гиперплазии ее лимфоидной ткани, увеличение количества мегакариоцитов в костном мозге.
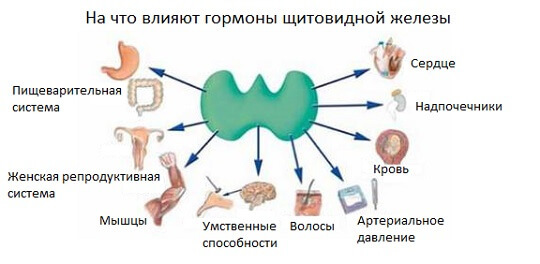
Регуляция гемопоэза
Кроветворение регулируется:
- факторами роста, обеспечивающими пролиферацию и дифференцировку СКК и последующих стадий их развития,
- факторами транскрипции, влияющими на экспрессию генов, определяющих направление дифференцировки гемопоэтических клеток,
- витаминами, гормонами.
Факторы роста включают колониестимулирующие факторы (КСФ), интерлейкины и ингибирующие факторы. Они являются гликопротеинами, действующими и как циркулирующие гормоны, и как местные медиаторы, регулирующие гемопоэз и дифференцировку специфических типов клеток. Почти все факторы роста действуют на СКК, КОЕ, коммитированные и зрелые клетки. Однако отмечаются индивидуальные особенности действия этих факторов на клетки-мишени.
КСФ действуют на специфические клетки или группы клеток на различных стадиях дифференцировки. Например, фактор роста стволовых клеток влияет на пролиферацию и миграцию СКК в эмбриогенезе. В постнатальном периоде на гемопоэз оказывают влияние несколько КСФ, среди которых наиболее изучены факторы, стимулирующие развитие гранулоцитов и макрофагов (ГМ-КСФ, Г-КСФ, М-КСФ), а также интерлейкины.
Большинство указанных факторов выделено и применяется для лечения различных болезней. Для получения их используются биотехнологические методы.
Дифференцировка полипотентных клеток в унипотентные определяется действием ряда специфических факторов, поэтинов — эритропоэтинов (для эритробластов), гранулопоэтинов (для миелобластов), лимфопоэтинов (для лимфобластов), тромбопоэтинов (для мегакариобластов).
Большая часть эритропоэтина образуется в почках. Его образование регулируется содержанием в крови кислорода, которое зависит от количества циркулирующих в крови эритроцитов. Снижение числа эритроцитов и соответственно парциального давления кислорода, является сигналом для увеличения продукции эритропоэтина. Эритропоэтин действует на чувствительные к нему КОЕ-Э, стимулируя их пролиферацию и дифференцировку, что в конечном итоге приводит к повышению содержания в крови эритроцитов.
Тромбопоэтин синтезируется в печени, стимулирует пролиферацию КОЕ-МГЦ, их дифференцировку и образование тромбоцитов.
Ингибирующие факторы дают противоположный эффект, т.е. тормозят гемопоэз; их недостаток может быть одной из причин лейкемии, характеризующейся значительным увеличением числа лейкоцитов в крови. Выделен ингибирующий лейкемию фактор (ЛИФ), который тормозит пролиферацию и дифференцировку моноцитов-макрофагов.
Витамины необходимы для стимуляции пролиферации и дифференцировки гемопоэтических клеток. Витамин В12 поступает с пищей и соединяется с внутренним фактором (Касла), который синтезируется париетальными клетками желудка. Образуемый при этом комплекс, в присутствии ионов Са2+, соединяется с рецепторами эпителиоцитов подвздошной кишки и всасывается. При всасывании в эпителиоциты поступает лишь витамин В12, а внутренний фактор освобождается. Витамин В12 поступает с кровью в костный мозг, где влияет на гемопоэз, и в печень, где может депонироваться. Нарушение процесса всасывания при различных заболеваниях желудочно-кишечного тракта может служить причиной дефицита витамина В12 и нарушений в гемопоэзе.
Некоторые термины из практической медицины:
- анемия (син. малокровие) — состояние, характеризующееся снижением содержания гемоглобина в единице объема крови, чаще при одновременном уменьшении количества эритроцитов;
- анемия ахрестическая — общее название анемий, развивающихся вследствие неспособности эритробластов костного мозга использовать какие-либо антианемические факторы (цианокобаламин, фолиевую кислоту, железо и др.) при их нормальном поступлении в организм;
- хлороз ранний (син.: бледная немочь, хлороз ювенильный) — железодефицитная анемия у девушек в период полового созревания, проявляющаяся алебастровой бледностью кожи с зеленоватым оттенком, извращением вкуса, олигоменореей;
- хлороз поздний (син. анемия железодефицитная эссенциальная) — железодефицитная анемия у женщин в возрасте старше 30 лет, обычно связанная с маточными или другими кровотечениями, проявляющаяся извращением вкуса и обоняния, признаками атрофии слизистой оболочки полости рта и пищевода, выпадением волос, искривлением ногтей, позже — выраженными признаками анемии;
Роль витамина В12 в кроветворении
В кроветворении принимают участие различные витамины, среди которых особая роль принадлежит витамину В12, содержащему кобальт.
Источником витамина В12 служат продукты животного происхождения; в растительных продуктах он отсутствует. Благодаря этому витамину поддерживается нормальный процесс созревания эритроцитов у здорового человека.
В сутки взрослому человеку необходимо 3—5 мг витамина В12. Как показали современные исследования, витамин В12, попавший в организм с пищей, всасывается в кишечнике лишь при соединении его с особым белком — гастромукопротеином (который иначе называется «внутренний фактор»).
Гастромукопротеин вырабатывается у человека железами желудка и обладает способностью образовывать с витамином В12 комплексное соединение. Оказалось, что этот белок предохраняет витамин от пожирания микроорганизмами, заселяющими кишечник. Таким образом, он выступает в роли «проводника» витамина В12 и спасает его от разрушающего действия микробов.
Всосавшийся витамин накапливается в печени и затем используется для целей кроветворения по мере необходимости.
Установлено, что витамин B12 принимает активное участие в образовании соединений, являющихся составными частями нуклеиновых кислот, — тех самых кислот, коими так богаты ядра клеток и которые определяют основные наследственные признаки организма.
В случае нехватки витамина B12 задерживается синтез нуклеиновых кислот, в результате чего неизбежно нарушается деление постоянно размножающихся кроветворных клеток. Тогда в костном мозге вместо нормальных эритробластов появляются огромные, медленно созревающие клетки, получившие название мегалобластов (от греческого слова «мегалос» — огромный).
Постэмбриональный гемопоэз
Постэмбриональный гемопоэз представляет собой процесс физиологической регенерации крови, который компенсирует физиологическое разрушение дифференцированных клеток. Он подразделяется на миелопоэз и лимфопоэз.
Миелопоэз происходит в миелоидной ткани, расположенной в эпифизах трубчатых и полостях многих губчатых костей. Здесь развиваются эритроциты, гранулоциты, моноциты, тромбоциты, а также предшественники лимфоцитов. В миелоидной ткани находятся стволовые клетки крови и соединительной ткани. Предшественники лимфоцитов постепенно мигрируют и заселяют тимус, селезенку, лимфоузлы и некоторые другие органы.
Лимфопоэз происходит в лимфоидной ткани, которая имеет несколько разновидностей, представленных в тимусе, селезенке, лимфоузлах. Она выполняет функции образования T- и B-лимфоцитов и иммуноцитов (например, плазмоцитов).
Миелоидная и лимфоидная ткани являются разновидностями соединительной ткани, т.е. относятся к тканям внутренней среды. В них представлены две основные клеточные линии — клетки ретикулярной ткани и гемопоэтические клетки.
Ретикулярные, а также жировые, тучные и остеогенные клетки вместе с межклеточным веществом формируют микроокружение для гемопоэтических элементов. Структуры микроокружения и гемопоэтические клетки функционируют в неразрывной связи друг с другом. Микроокружение оказывает воздействие на дифференцировку клеток крови (при контакте с их рецепторами или путем выделения специфических факторов).
Таким образом, для миелоидной и всех разновидностей лимфоидной ткани характерно наличие стромальных и гемопоэтических элементов, образующих единое функциональное целое.
СКК относятся к самоподдерживающейся популяции клеток. Они редко делятся. Выявление СКК стало возможным при применении метода образования клеточных колоний – потомков одной стволовой клетки.
Пролиферативную активность СКК регулируют колониестимулирующие факторы (КСФ), различные виды интерлейкинов (ИЛ-3 и др.).
Каждая СКК в эксперименте или лабораторном исследовании образует одну колонию и называется колониеобразующей единицей (сокращенно КОЕ, CFU).
Исследование клеточного состава колоний позволило выявить две линии их дифференцировки.
Одна линия дает начало мультипотентной клетке — родоначальнице гранулоцитарного, эритроцитарного, моноцитарного и мегакариоцитарного рядов гемопоэза (сокращенно КОЕ-ГЭММ).
Вторая линия дает начало мультипотентной клетке — родоначальнице лимфопоэза (КОЕ-Л).
Из мультипотентных клеток дифференцируются олигопотентные (КОЕ-ГМ) и унипотентные родоначальные клетки.
Методом колониеобразования определены родоначальные унипотентные клетки для моноцитов (КОЕ-М), нейтрофильных гранулоцитов (КОЕ-Гн), эозинофилов (КОЕ-Эо), базофилов (КОЕ-Б), эритроцитов (БОЕ-Э и КОЕ-Э), мегакариоцитов (КОЕ-МГЦ), из которых образуются клетки-предшественники. В лимфопоэтическом ряду выделяют унипотентные клетки — предшественницы для B-лимфоцитов и для T-лимфоцитов. Полипотентные (плюрипотентные и мультипотентные), олигопотентные и унипотентные клетки морфологически не различаются.
Все приведенные выше стадии развития клеток составляют четыре основных класса, или компартмента, гемопоэза:
- I класс — СКК — стволовые клетки крови (плюрипотентные, полипотентные);
- II класс — КОЕ-ГЭММ и КОЕ-Л — коммитированные мультипотентные клетки (миелопоэза или лимфопоэза);
- III класс — КОЕ-М, КОЕ-Б и т.д. — коммитированные олигопотентные и унипотентные клетки;
- IV класс — клетки-предшественники (бласты, напр.: эритробласт, мегакариобласт и т.д.).
Сразу отметим, что оставшиеся два класса гемопоэза составляют созревающие клетки (V класс) и зрелые клетки крови (VI класс).
Эритропоэз у млекопитающих и человека протекает в костном мозге в особых морфофункциональных ассоциациях, получивших название эритробластических островков.
Эритробластический островок состоит из макрофага, окруженного одним или несколькими кольцами эритроидных клеток, развивающихся из унипотентной КОЕ-Э, вступившей в контакт с макрофагом. КОЕ-Э и образующиеся из нее клетки (от проэритробласта до ретикулоцита) удерживаются в контакте с макрофагом его рецепторами.
У взрослого организма потребность в эритроцитах обычно обеспечивается за счет усиленного размножения эритробластов. Но всякий раз, когда потребность организма в эритроцитах возрастает (например, при потере крови), эритробласты начинают развиваться из предшественников, а последние — из стволовых клеток.
В норме из костного мозга в кровь поступают только эритроциты и ретикулоциты.
Свойства колониеобразующих тканей
Из соединений могут формироваться предшественники эритроцитов, которые носят название ретикулоцитов, а также эозинофилов, моноцитов и и базофилов. Образование клеток плазмы и Т-лимфоцитов происходит с участием селезенки, тимуса и ткани лимфы. Процессы захвата могут иметь место в селезенке.
Говоря про колониеобразующие ткани, надо указать гемоцитопоэзиндуцирующее микроокружение (ГИМ). В процессе его образования принимают участие элементы, входящие в состав паренхимы костного мозга и стромы. Они отвечают за образование макрофагов, эндотелиоцитов капилляров и более крупных сосудов. Эти компоненты выступают основой для закладки нервно-мышечных тканей. ГИМ передают в клетки специальные сигналы, направленные на регуляцию той или иной функции.
Микроокружение участвует в обеспечении полноценного метаболизма. Гемоцитопоэз состоит из множества сложных этапов. Он отвечает за поддержание постоянства, торможения или ускорения деятельности клеток. Регуляция интенсивности гемопоэза должна происходить сообразно меняющимся потребностям органов и систем. При этом может происходить как торможение, так и ускорение, в зависимости от обстоятельств. Обязательно является поступление информации в виде сигналов. Это обеспечивается нейромедиаторами и гормонами.
Кроветворение будет полноценным, если синтезируется достаточно пластических и энергетических веществ, минералов, витаминов. Регуляция базируется на образовании взрослых клеток из стволовых, расположенных в тканях костного мозга, и гормонов с нейромедиаторами. В нем принимают участие цитокины. Факторы микроокружения способны стимулировать гемопоэз, другие направлены на процесс торможения. Транскрипционные отвечают за внутреннюю регуляцию дифференцировки в клеточных ядрах.
Воздействие на кроветворные стволовые клетки обеспечивается влиянием на них нескольких факторов одновременно. Специфические рецепторы, которые включены в состав клеток крови, испытывают на себе стимулирующее действие указанных веществ и факторов.
Предыдущая
АнатомияЭритроциты в крови где образуются, строение, функции и продолжительность жизни, что значит повышенные эритроциты, какая норма, где в организме человека происходит разрушение эритроцитов
Следующая
АнатомияСтроение уха человека схема с описанием, что расположено в средней части уха, анатомия внутреннего и наружного уха, ушной раковины, барабанная полость
Депо крови
Депо крови – это ткани или органы, способные накапливать значительное количество крови, которая может использоваться организмом при необходимости
В состоянии покоя около 5% циркулирующей крови находится в капиллярах, а также в сердце, 20% в артериях и 70% в венах, что свидетельствует о важности венозных сосудов и в качестве резервуара крови. Таким образом, некоторые сосудистые области – печень, подкожная клетчатка, легкие, брюшные вены и селезенка – играют роль складов крови, из которых, при необходимости, больше крови включается в артериальное кровообращение
Значение селезенки как депо крови было разъяснено Д. Араховацем. Это очень крупное депо крови, где накапливается около 8-12% её объема. Печень также способна хранить значительное количество крови, но не так много, как селезенка. Кровь в печени сосредоточена в синусоидах.
При кровопотере в результате симпатической стимуляции венозные сосуды в хранилищах (депо) крови сужаются, и вытесненная ими кровь может компенсировать уменьшение объема циркулирующей крови
Важно отметить, что компенсация возможна, когда речь идет о потере 20% от общего количества крови (эквивалентно примерно 1 литру крови). Это причина, по которой внезапные небольшие кровопотери у здоровых людей (при рождении, сдаче крови) относительно хорошо переносятся и не вызывают значительных нарушений гемодинамики
Когда, однако, потеря крови происходит быстро и носит массивный характер (более 1/3 общего объема крови), организм не в состоянии это компенсировать. Затем, из-за общего нарушения кровообращения, может наступить смертельный исход.
В связи с тем, что объем и линейная скорость крови в хранилищах крови очень низкие, создаются условия для удержания стенок клеток крови. В результате значение гематокрита крови в хранилищах крови увеличивается.
Особенности процесса образования клеток крови: теории и факты
Процесс образования клеток крови идет непрерывно в течение всей человеческой жизни, интенсивность его строго соответствует потребностям организма.
По одной из современных теорий следует, что клетки крови человека — эритроциты, лейкоциты и тромбоциты происходят из единой родоначальной материнской клетки, так называемой «стволовой». Путем ее деления и развития появляются клепки, предопределяющие различные ветви кроветворения: образование эритроцитов, зернистых лейкоцитов (гранулоцитов), незернистых лейкоцитов (агранулоцитов), тромбоцитов.
Порожденная общей «стволовой» клеткой, каждая из этих ветвей имеет и свою собственную родоначальную клетку. В процессе деления и постепенного созревания и преобразования этих костномозговых элементов появляются зрелые клетки, поступающие в кровь.
К чести русской науки следует оказать, что мысль о происхождении всех клеток крови из единого источника принадлежит знаменитому русскому ученому-гистологу А. А. Максимову, создавшему еще в 1900—1914 гг. свою теорию кроветворения. Эти исследования нашли подтверждение и дальнейшее развитие в трудах советских исследователей.
Вместе с тем в некоторыми учеными высказывалась мысль о том, что еще до рождения человека в кроветворных органах предопределен вид каждой кроветворной линии — гранулоцитарной, эритроцитарной, лимфоцитарной. В пользу такой точки зрения приводятся данные биохимических исследований клеток крови и костного мозга.
Так, советские биохимики П. Ф. Сейц и П. С. Луганова обнаружили, что для определенных линий кроветворных элементов характерен определенный вид энергетического обмена. На основании этих данных они полагали, что и происхождение клеточных форм на каком-то этапе должно быть различным, поскольку характерный тип обмена (как группа крови, резус-фактор), возникший в клетке в начальном периоде ее развития, сохраняется во всех клеточных популяциях (производных данной линии).