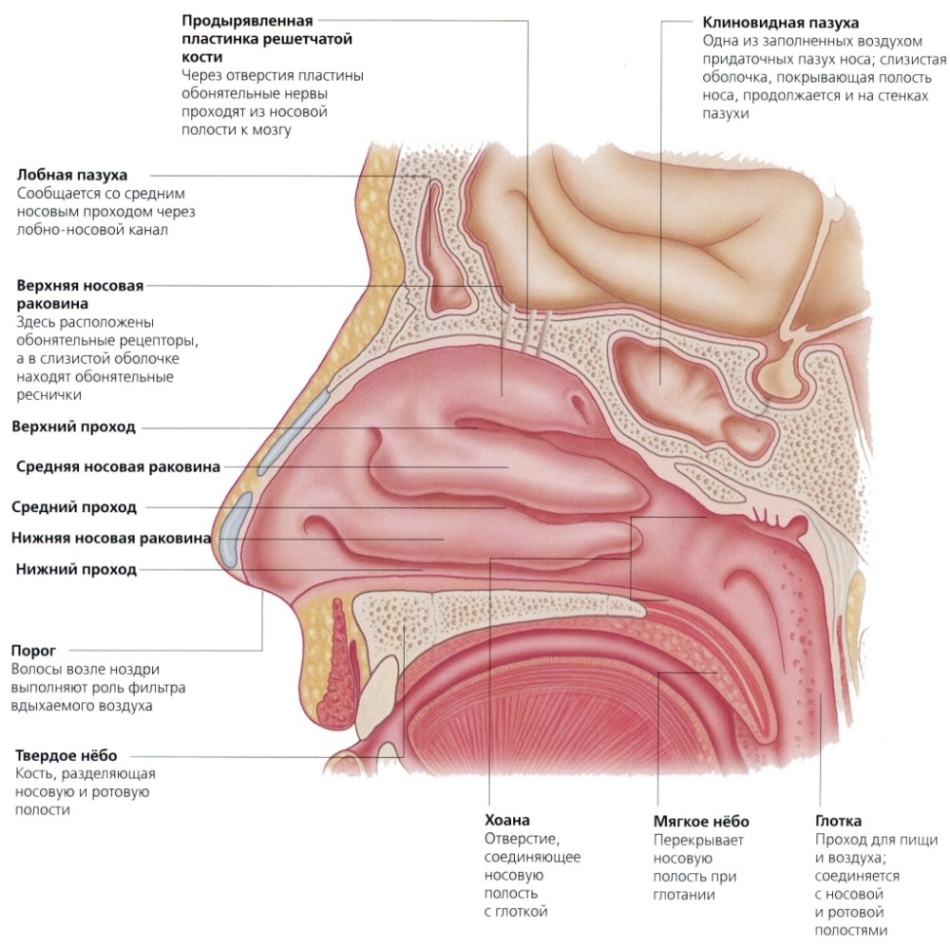
Органы кроветворения и иммунной защиты
Содержание:
- Лимфоциты
- Контроль гемоцитопоэза
- Результаты исследований
- Прогнозы
- Распространённость б
- Особенности процесса образования клеток крови: теории и факты
- Заболевания костного мозга
- Систематизация
- Причины развития лейкемии
- Что такое лейкемия?
- Что будет, если гемопоэз нарушится
- В Т- и в В-лимфоцитопоэзе выделяют три этапа:
- Эмбриональное кроветворение.
- Типы кроветворных тканей
- Селезенка
- Лимфатические узлы
- Нормальные значения
Лимфоциты
Под этим термином подразумеваются небольшие одноядерные клетки. Лимфоциты в своём большинстве имеют размер до 10 мкм. Ядра таких клеток круглые и плотные, а цитоплазма состоит из мелких гранул и окрашена в голубоватый цвет. При поверхностном изучении можно заметить, что все лимфоциты имеют одинаковый вид. Это не меняет следующего факта — они различаются по свойствам клеточной мембраны и своим функциям.
Эти одноядерные элементы крови делятся на три основные категории: 0-клетки, B-клетки и T-клетки. Функция В-лимфоцитов заключается в том, чтобы служить предшественниками клеток, которые образуют антитела. В свою очередь, Т-клетки обеспечивают трансформацию В-лейкоцитов. Стоит отметить, что Т-лимфоциты — это специфическая группа клеток иммунной системы, которая выполняет несколько важных функций. Например, с их участием происходит процесс синтезирования факторов активации макрофагов и факторов роста интерферонов, равно как и В-клеток. Можно выделить и индукторные Т-клетки, которые участвуют в стимуляции образования антител. На примере действия различных категорий лимфоцитов отчетливо видна взаимосвязь состава и функции крови.
Что касается 0-клеток, то они значительно отличаются от остальных, поскольку не имеют поверхностных антигенов. Некоторые из этих элементов крови выполняют функцию «естественных киллеров», уничтожая те клетки, которые имеют структуру раковых или заражены вирусом.
Контроль гемоцитопоэза
Гемоцитопоэз объединяет процессы, связанные с преобразованием различных клеток в зрелые элементы крови. Так обеспечивается естественное сокращение лишнего количества форменных элементов. Полипотентные стволовые клетки самостоятельно проходят регенерацию. Они могут образовываться вне органов кроветворения. При стандартной дифференциации полипотентные клетки, сосредоточенные в костном мозге, способствуют зарождению зрелых элементов крови. Это:
- базофилы;
- эритроциты;
- различные типы лимфоцитов;
- эозинофилы;
- нейтрофилы.
К ним относят:
- попадание инфекции в организм;
- механические повреждения и другие факторы, способствующие потере определенного количества крови;
- адаптация к условиям высокогорья.
Результаты исследований
Ученые определили, как организм реагирует во время чрезвычайных ситуаций, когда ему нужно продуцировать больше клеток крови. В исследовании сообщается, что при повреждении ткани во время чрезмерного кровотечения или во время беременности в селезенке активируется вторичная система экстренного типа.
Кроветворные стволовые структуры обитают главным образом в костном мозге, и большинство новых клеток образуется здесь при нормальных обстоятельствах. Но когда возникает гемопатический стресс, система кроветворения работает так, что область ее влияния расширяется до селезенки. Кроветворные стволовые клетки мигрируют туда из костного мозга. В этом гемопатическом органе и происходит образование новых структур.
Прогнозы
Рак крови (симптомы, фото больных с этим заболеванием представлены в данной статье), конечно, очень страшное заболевание. Исход его напрямую зависит от формы опухоли. Так, при острых лейкозах гибель наступает гораздо быстрее, чем при иных формах рака крови. Лейкозы хронические лечатся лучше.
Таким образом, рак крови характеризуется нарушениями в образовании эритроцитов, тромбоцитов и лейкоцитов. Это заболевание может протекать в двух формах: острой и хронической. При острой форме рака больные умирают на протяжении нескольких недель или месяцев. Если форма хроническая, то возможна ремиссия болезни при своевременном обнаружении болезни и лечении.
Рак крови представляет собой заболевание, развитие которого берёт начало из одной клетки, что находится в костном мозге. Она неконтролируемо делится за короткий временной период, вытесняет рост здоровых клеток крови. Соответственно, симптомы заболевания напрямую связаны с недостатком в человеческом организме определённых нормальных клеток. Опухоли как таковой нет, она как бы рассеяна по всему организму и циркулирует с кровяным током.
Злокачественные заболевания часто встречаются у детей от двух до пяти лет. Связано это, скорее всего, с воздействием радиации, а также с наследственностью. Заболевание проявляется следующими симптомами: болями в спине, костях, суставах, быстрой утомляемостью, бледностью кожи, увеличением селезёнки, печени и так далее.
Распространённость б
Болезни крови человека не входят в число самых популярных в мире заболеваний. Однако, согласно сведениям ВОЗ, распространенность среди населения ряда государств комплексных заболеваний крови, неуклонно растёт.
Поэтому, актуальным представляется расширение сети учреждений, выполняющих гематологические исследования с диагностической целью, изыскание способов противостояния патологии. Стоит задача создания дополнительных мест в гематологических клиниках, повышения квалификации и переподготовки врачей поликлиник.
Врачи обязаны иметь понятия о клинических симптомах, указывающих на болезни крови, чтобы вовремя направить больного к гематологу.
Динамика роста болезней крови
Особенности процесса образования клеток крови: теории и факты
Процесс образования клеток крови идет непрерывно в течение всей человеческой жизни, интенсивность его строго соответствует потребностям организма.
По одной из современных теорий следует, что клетки крови человека — эритроциты, лейкоциты и тромбоциты происходят из единой родоначальной материнской клетки, так называемой «стволовой». Путем ее деления и развития появляются клепки, предопределяющие различные ветви кроветворения: образование эритроцитов, зернистых лейкоцитов (гранулоцитов), незернистых лейкоцитов (агранулоцитов), тромбоцитов.
Порожденная общей «стволовой» клеткой, каждая из этих ветвей имеет и свою собственную родоначальную клетку. В процессе деления и постепенного созревания и преобразования этих костномозговых элементов появляются зрелые клетки, поступающие в кровь.
К чести русской науки следует оказать, что мысль о происхождении всех клеток крови из единого источника принадлежит знаменитому русскому ученому-гистологу А. А. Максимову, создавшему еще в 1900—1914 гг. свою теорию кроветворения. Эти исследования нашли подтверждение и дальнейшее развитие в трудах советских исследователей.
Вместе с тем в некоторыми учеными высказывалась мысль о том, что еще до рождения человека в кроветворных органах предопределен вид каждой кроветворной линии — гранулоцитарной, эритроцитарной, лимфоцитарной. В пользу такой точки зрения приводятся данные биохимических исследований клеток крови и костного мозга.
Так, советские биохимики П. Ф. Сейц и П. С. Луганова обнаружили, что для определенных линий кроветворных элементов характерен определенный вид энергетического обмена. На основании этих данных они полагали, что и происхождение клеточных форм на каком-то этапе должно быть различным, поскольку характерный тип обмена (как группа крови, резус-фактор), возникший в клетке в начальном периоде ее развития, сохраняется во всех клеточных популяциях (производных данной линии).
Заболевания костного мозга
Далее рассмотрим список болезней данного органа, которые при своевременной диагностике поддаются лечению:
- Лейкоз – это рак белых кровяных клеток. Они влияют на все пять типов лимфоцитов. Тяжелый недуг распространяется на линию элементов, что приводит к разрушению производства других клеток. При поражении лейкозные элементы пациента нормально не функционируют или не борются с инфекциями.
- Миелодиспластический синдром или цитопения – это группа заболеваний. Характером данной группы является производство патологических аномальных ячеек органа. Это приводит к кровотечениям, анемии и заражению различными инфекциями. Если не лечить данные заболевания, они стремительно прогрессируют, приводя к острой миелоидной лейкемии. Миелопролиферативные заболевания распространяются по всей ткани. Орган перепроизводит зрелые ростки клеток, которые он выпускает в кровеносную систему, другими словами, это гиперплазия.
- Миелопролиферативные заболевания и другие. Для определения этих заболеваний у больного, их дальнейшего лечения применяют пункцию костной ткани. Это диагностический метод, с помощью которого врачи получают образец вашего органа из любой кости, где содержится орган. Для этого вводят специальную иглу. Затем материал отправляют на анализ, чтобы определить нарушение или отсутствие определенного количества элементов.
С помощью процедуры специалисты выясняют, можно ли взять человека в качестве донора, нужна ли ему пересадка клеток, и готов ли он к проведению трансплантации. Если анализы удовлетворительные, его отправляют на операцию, ход которой человек определяет самостоятельно. Перед трансплантацией проводят полное исследование состояния организма: сердца, легких почек и других органов.
Чувствительность к цитостатикам и излучению
Элементы, которые вырабатываются здоровым кроветворным органом, обладают повышенной чувствительностью к цитостатическим или ионизирующим излучениям. Однако при химиотерапии или облучении страдают только злокачественные опухоли. Они либо исчезают, либо не размножаются. Передозировка этими средствами приводит к апластической анемии. После проведения химиотерапии клеточные популяции возможно полностью восстановить за счет первичного резерва костной ткани.
Систематизация
Клиническая классификация подразделяет болезни крови человека по одной, наиболее характерной патологии, на четыре подгруппы:
- Анемии. Характерная патология—низкий гемоглобин в крови;
- Повышенная кровоточивость. У пациента наблюдают склонность к вторичным кровотечениям. После случайных небольших травм или самопроизвольно, развиваются кровоизлияния из-за нарушения свёртываемости крови;
- Опухолевые поражения костного мозга и лимфоидной ткани;
- Прочие патологии.
В каждой из подгрупп выделяют многообразие заболеваний в зависимости от клинических симптомов, поражения тех или иных бластных клеток;
Все симптомы болезни крови подразделяют на местные, учитывающие патологии какого- то одного органа кроветворения и системные. Некоторые болезни связанные с кровью имеют сходные клинические симптомы.
Причины развития лейкемии
До сих пор исследователи не могли точно определить причину этого вида рака. Однако они считают, что это происходит из-за радиации и мутаций в ДНК. Исследователи онкологических заболеваний говорят, что разные типы лейкемии имеют разные причины:
- Облучение. Излучение высокой энергии может вызвать значительные изменения в ДНК. Эти изменения могут спровоцировать развитие лейкемию. Большие дозы облучения увеличивают риск появления онкологии у животных и людей. Международное агентство по изучению рака сообщило, что имеются ограниченные доказательства того, что высокие уровни магнитно-немагнитных полей с крайне низкой частотой могут вызывать некоторые случаи детской лейкемии;
- Генетическая предрасположенность. Некоторые люди склонны к развитию лейкемии по генетическим причинам. Мутация в гене может вызвать лейкемию у детей. Люди с синдромом Дауна имеют значительно повышенный риск развития форм острого лейкоза.
Что такое лейкемия?
Это тип рака, который вызывает аномальный рост лейкоцитов. Рождение, рост и смерть любого типа клеток — естественный процесс. Когда этот процесс нарушается по какой-то причине, он порождает новые неразвитые клетки, которые в случае лейкемии называются бластами или лейкозами. Эта болезнь поражает органы кроветворения и иммунной системы.
Эта хаотическая аномалия в естественном процессе приводит к тому, что нормальные клетки крови умирают через некоторое время и заменяются новыми — бластами, которые продуцируются в костном мозге. Бласты, в свою очередь, не умирают так легко и накапливаются, занимая все больше и больше пространства. Патологический процесс происходит в лейкоцитах. Это разрушение естественного процесса в костном мозге и называется лейкемией.

Что будет, если гемопоэз нарушится
К сожалению, встречаются заболевания, при которых нарушается одно или несколько звеньев производства крови. В зависимости от того, на каком уровне это произошло, тяжесть заболевания и его проявления будут варьировать.
Нарушение производства эритроцитов
Такое состояние возникает, если эритропоэз остановился до полного образования эритроцита. Основными проявлениями проблемы будут:
- снижение уровня гемоглобина в крови
- появление патологических форм гемоглобина
- повышенное разрушение недозрелых форм леток и, как
- следствие, появление желтухи
Нарушение производства лейкоцитов
Обычно такое нарушение связано с повышенной выработкой миелобластов или лимфоцитов, при этом развивается состояние знакомое всем как лейкоз. Клинически лейкоз появляется снижением общего иммунитета, присоединением множества инфекций и ненормальной реакцией организма на обычные процессы.
Нарушение производства тромбоцитов
Изменения в этом звене гемопоэза очень опасны, так как быстрее предыдущих ведут к гибели. Вся причина в том, что несовершенные тромбоциты не могут адекватно выполнить адгезивную функцию. Следовательно, даже малейшие повреждения будут сопровождаться массивными кровотечениями.
В заключении хочется сказать, что тонкие механизмы гемопоэза, практически не подвластны человеческому воздействию. Поэтому возникшие в них ошибки исправить бывает очень трудно.
Сен 29, 2016
В Т- и в В-лимфоцитопоэзе выделяют три этапа:
- костномозговой этап;
- этап антиген—независимой дифференцировки, осуществляемый в центральных иммунных органах;
- этап антиген—зависимой дифференцировки, осуществляемый в периферических лимфоидных органах.
Первый этап Т-лимфоцитопоэза осуществляется в лимфоидной ткани красного костного мозга, где образуются следующие классы клеток:
- 1 класс — стволовые клетки;
- 2 класс — полустволовые клетки-предшественницы лимфоцитопоэза;
- 3 класс — унипотентные Т-поэтинчувствительные клетки—предшественницы Т-лимфоцитопоэза, эти клетки мигрируют в кровеносное русло и с кровью достигают тимуса.
Второй этап — этап антигеннезависимой дифференцировки осуществляется в корковом веществе тимуса. Здесь продолжается дальнейший процесс Т-лимфоцитопоэза. Под влиянием биологически активного вещества тимозина, выделяемого стромальными клетками, унипотентные клетки превращаются в Т-лимфобласты — 4 класс, затем в Т-пролимфоциты — 5 класс, а последние в Т-лимфоциты — 6 класс.
Третий этап — этап антигенезависимой дифференцировки осуществляется в Т-зонах периферических лимфоидных органов — лимфоузлов, селезенки и других, где создаются условия для встречи антигена с Т-лимфоцитом (киллером, хелпером или супрессором), имеющим рецептор к данному антигену.
Первый этап В-лимфоцитопоэза осуществляется в красном костном мозге, где образуются следующие классы клеток:
- 1 класс — стволовые клетки;
- 2 класс — полустволовые клетки-предшественницы лимфопоэза;
- 3 класс — унипотентные В-поэтинчувствительные клетки-предшественницы В-лимфоцитопоэза.
Второй этап антигеннезависимой дифференцировки у птиц осуществляется в специальном центральном лимфоидном органе — фабрициевой сумке.
Третий этап — антигензависимая дифференцировка осуществляется в В-зонах периферических лимфоидных органов (лимфатических узлов, селезенки и других) где происходит встреча антигена с соответствующим В-рецепторным лимфоцитом, его последующая активация и трансформация в иммунобласт.
Эмбриональное кроветворение.
Кроветворение во внутриутробном периоде
развития начинается рано. По мере роста
эмбриона и плода последовательно
меняется локализация гемопоэза в
различных органах.
Табл. 1. Развитие гемопоэтической системы
человека
(по Н.С. Кисляк, Р.В. Ленской, 1978).
|
Локализация кроветворения |
Период эмбриогенеза (недели) |
|
Желточный мешок |
3 – 4 |
|
Начало кроветворения в печени |
5 – 6 |
|
Появление больших лимфоцитов в тимусе |
9 – 10 |
|
Начало гемопоэза в селезенке |
Конец 12-й |
|
Появление гемопоэтических очагов в |
13 – 14 |
|
Лимфопоэз в лимфоузлах |
16 – 17 |
|
Появление циркулирующих малых |
17 |
|
Начало лимфопоэза в селезенке |
20 |
Начинается кроветворение в желточном
мешке на 3-й неделе развития человеческого
эмбриона. В начале оно сводится в основном
к эритропоэзу. Образование первичных
эритробластов (мегалобласты) происходит
внутри сосудов желточного мешка.
На 4-й неделе кроветворение появляется
в органах эмбриона. Из желточного мешка
гемопоэз перемещается в печень, которая
к 5-й недели гестации становится центром
кроветворения. С этого времени наряду
с эритроидными клетками начинают
образовываться первые гранулоциты и
мегакариоциты, при этом мегалобластический
тип кроветворения сменяется на
нормобластический. К 18-20-й неделе развития
человеческого плода кроветворная
активность в печени резко снижена, а к
концу внутриутробной жизни, как правило,
совсем прекращается.
В селезенке кроветворение начинается
с 12-й недели, образуются эритроциты,
гранулоциты, мегакариоциты. С 20-й недели
миелопоэз в селезенке сменяется
интенсивным лимфопоэзом.
Первые лимфоидные элементы появляются
на 9-10 неделе в строме тимуса, в процессе
их дифференцировки образуются
иммунокомпетентные клетки – Т-лимфоциты.
К 20-й неделе тимус по соотношению малых
и средних лимфоцитов сходен с тимусом
доношенного ребенка, к этому времени в
сыворотке крови плода начинают
обнаруживаться иммуноглобулины М и G.
Костный мозг закладывается в конце 3-го
месяца эмбрионального развития за счет
мезенхимальных периваскулярных
элементов, проникающих вместе с
кровеносными сосудами из периоста в
костномозговую полость. Гемопоэтические
очаги в костном мозге появляются с 13-14
недели внутриутробного развития в
диафизах бедренных и плечевых костей.
К 15-й неделе в этих локусах отмечается
обилие юных форм грануло-, эритро- и
мегакариоцитов. Костномозговое
кроветворение становится основным к
концу внутриутробного развития и на
протяжении всего постнатального периода.
Костный мозг в пренатальном периоде
красный. Его объем с возрастом плода
увеличивается в 2,5 раза и к рождению
составляет порядка 40 мл. и он присутствует
во всех костях. К концу гестации начинают
появляться в костном мозге конечностей
жировые клетки. После рождения в процессе
роста ребенка масса костного мозга
увеличивается и к 20 годам составляет в
среднем 3000 г, но на долю красного костного
мозга будет приходиться порядка 1200 г,
и он будет локализоваться в основном в
плоских костях и телах позвонков,
остальная часть будет замещена желтым
костным мозгом.
Основным отличие состава форменных
элементов крови плода является постоянное
нарастание числа эритроцитов, содержания
гемоглобина, количества лейкоцитов.
Если в первой половине внутриутробного
развития (до 6 месяцев) в крови обнаруживаются
много незрелых элементов (эритробластов,
миелобластов, промиелоцитов и миелоцитов),
то в последующие месяцы в периферической
крови плода содержатся преимущественно
зрелые элементы.
Изменяется и состав гемоглобина. Вначале
(9-12 нед) в мегалобластах находится
примитивный гемоглобин (HbP),
который заменятся фетальным (HbF).
Он становится основной формой в
пренатальном периоде. Хотя с 10-й недели
начинают появляться эритроциты с
гемоглобином взрослого типа (HbA),
доля его до 30 недели составляет лишь
10%. К рождению ребенка фетальный гемоглобин
составляет приблизительно 60%, а взрослый
– 40% всего гемоглобина эритроцитов
периферической крови
Важным физиологическим
свойством примитивного и фетального
гемоглобинов является их более высокое
сродство к кислороду, что имеет важное
значение во внутриутробном периоде для
обеспечения организма плода кислородом,
когда оксигенация крови плода в плаценте
относительно ограничена по сравнению
с оксигенацией крови после рождения в
связи с установлением легочного дыхания
Типы кроветворных тканей
Кроветворная ткань делится на 2 типа тканей:
Миелоидная ткань
Это тип кроветворной ткани, связанный с продукцией эритроцитов (эритропоэз), гранулированных лейкоцитов и мегакариоцитов. Фрагменты мегакариоцитов образуют тромбоциты (тромбоциты).
Миелоидная ткань расположена на уровне медуллярного канала и пространства трабекулярной кости длинных костей у молодых животных. У взрослых животных оно ограничено только на уровне эпифизов длинных костей.
На эмбриональной стадии эта ткань обнаруживается в печени и селезенке и может сохраняться даже в течение первых недель жизни. У людей миелоидная ткань обычно ограничивается костным мозгом ребер, грудины, позвонков и эпифизами длинных костей тела..
Лимфоидная ткань
Лимфоидная ткань также является кроветворной тканью. Эта ткань существует в очень хорошо определенных органах, которые имеют покрытие соединительной ткани. Он называется инкапсулированной лимфатической тканью, а органы, которые ее представляют, — это лимфатические узлы, селезенка и тимус.
Существует также неинкапсулированная лимфатическая ткань, которая образует защитный барьер в организме; в органах, подверженных загрязнению окружающей среды, таких как подслизистая оболочка кишечника, дыхательные пути, мочевыводящие пути и половые органы.
Селезенка
Селезенка принимает активное участие в кроветворении в период эмбриогенеза и после рождения. В течение всей жизни она выполняет функции периферического лимфоидного органа. В нем выделяют участки красной и белой пульпы:
- Первая из них образована сетью синусоидов, заполненных макрофагами и эритроцитами.
- В белой пульпе находятся артерии с окружающей их лимфоидной тканью, заселенной Т-лимфоцитами. В-лимфоциты также располагаются в этой зоне, но более удаленно от артерий.
Селезенка одновременно является депо и местом разрушения красных кровяных телец, выполнивших свои функции или имеющих аномальную структуру. Кроме того, она является органом иммунной системы и участвует в элиминации из организма патогенных микробов и антигенов.
Лимфатические узлы
Лимфоузлы являются периферическим органом кроветворения и важной составляющей частью иммунной системы. Они представляют собой образования овальной или округлой формы, состоящие из сети ретикулярных волокон, между которыми находятся лимфоциты, макрофаги и дендритные клетки
С морфологической точки зрения лимфатический узел можно разделить на три зоны – корковую, субкапсулярную и мозговую:
- В первой из них располагаются В-лимфоциты и макрофаги, образующие первичные фолликулы. После антигенной стимуляции в этой области формируются вторичные фолликулы.
- Субкапсулярная зона заполнена Т-лимфоцитами.
- В медуллярной зоне находятся более зрелые клетки, большинство из которых способны вырабатывать антитела.
Несмотря на то, что лимфоузлы располагаются группами по ходу лимфатических сосудов и рассредоточены по всему организму на значительном расстоянии друг от друга, они тесно взаимосвязаны между собой и выполняют единые функции.
Их формирование заканчивается к 12-15 годам, после 20 лет начинается процесс возрастной инволюции.
Пейеровы бляшки представляют собой скопления лимфоидной ткани по ходу тонкой кишки, их строение аналогично лимфоидным фолликулам лимфатических узлов.
Нормальные значения
Лабораторный подсчет NEU в клиническом анализе – это число клеток на 1 мл крови или 1 000 000 000 клеток на литр (в бланке анализа обозначается, как 10^9/л) и носит название абсолютного числа (абс.) нейтрофильных гранулоцитов. Норма абсолютного числа сегментоядерных (зрелых) у подростков старше 16 лет и у взрослых составляет 1,8-6,5 * 10^9/л.
Норма абс. палочкоядерных (незрелых) клеток – 0,04–0,30 * 10^9/л. Более простой подсчет – измерение относительного числа форменных нейтрофильных элементов в процентном соотношении к общему числу лейкоцитов. Начиная с 16-летнего возраста, референсные значения для зрелых нейтрофилов – 45-70%, незрелых – 1-6%.
В крови у детей количество зрелых и незрелых нейтрофильных гранулоцитов зависит от возраста.
Нормальные относительные показатели по возрасту (в %)
| Возраст ребенка | После рождения | Младенец до года | 2-4 года | 4-8 лет | 8-12 лет | 12-14 лет | 14-16 лет |
| Зрелые клетки | 48-72 | 15-46 | 33-56 | 33-59 | 43-59 | 44-60 | 44-65 |
| Незрелые клетки | 4-11 | 1-6 | 1-5 | 1-5 | 0-5 | 0-4 | 1-5 |
Несущественная нейтрофилия допускается у женщин, вынашивающих ребенка. При беременности активизируется кроветворение, снижается иммунитет, биохимические процессы полностью перестраиваются.
В случае когда сегментоядерные нейтрофилы значительно повышены (в 1,5-2 раза), это значит, что в организме активно прогрессирует инфекция, угрожающая преждевременными родами или выкидышем.
Общие значения для беременных женщин
Отклонения от нормальных значений свидетельствуют о нарушениях. Высокие показатели чаще всего указывают на острые инфекционно-воспалительные процессы, связанные с бактериальной или грибковой активностью.
Низкий уровень зрелый нейтрофильных лейкоцитов требует наблюдения в динамике. Расшифровкой полученных из лаборатории результатов ОКА крови занимается врач, направивший на исследование.