Формула для расчета гемоглобина
Содержание:
- Нормальные показатели железосодержащего белка
- Диагностическое значение
- Диагностика заболеваний по уровню гемоглобина F
- Что такое сывороточный гемоглобин?
- Примечания[править | править код]
- Что такое миоглобин
- Виды гемоглобина
- Какие опасные разновидности гемоглобина существуют?
- Виды гемоглобина и его функции
- Патологические формы гемоглобина
- Физиология
- Строение
- Физиология[править | править код]
- Виды
- Что такое миоглобин?
- Нормы гемоглобина в крови по возрастам
- Гемоглобин при заболеваниях крови[править | править код]
Нормальные показатели железосодержащего белка
Расшифровкой анализа общеклинического исследования сыворотки крови должен заниматься только врач. Однако выделяют некоторые общие нормы гемоглобина, присущие всем людям. Уровень данного ПС измеряется в г/л (граммы на литр). В зависимости от лаборатории методики анализа могут различаться.
Норма дезоксигемоглобина в крови у различных возрастных групп:
- Мужчины от 18 лет – 120-150 г/л,
- Женщины от 18 лет – 110-130,
- Маленький ребенок – 200,
Повышение или снижение уровня свободного гемоглобина может приводить к патологиям. Первичная гемоглобинопатия обусловлена наследственными причинами, поэтому не лечится на любых этапах развития. Однако существуют методы стабилизации пациентов, поэтому в любом случае нужно обратиться к врачу. При серьезном снижении уровня данного ПС в кровеносном русле показан искусственный кровезаменитель.
Диагностическое значение
Выраженная Г. (125—200 мг% и выше) патогномонична для гемолитических анемий, протекающих с внутрисосудистым гемолизом: при острых отравлениях гемолитическими ядами, энзимопенических гемолитических анемиях, пароксизмальной ночной гемоглобинурии, гемолитической болезни новорожденных, а также при гемолитических кризах в результате тяжелых посттрансфузионных реакций, при групповой или резус-несовместимости. При гемолитических анемиях, обусловленных преимущественно внутриклеточным гемолизом, выраженную Г. не обнаруживают. Легкая Г. (до 25 мг%) отмечается при некоторых гемоглобинопатиях (серповидноклеточная анемия и ее варианты, талассемия, гемоглобиноз С), при аутоиммунной гемолитической и пернициозной анемии, резорбции гематом. Легчайшая Г. (5—15 мг%) может иметь место при отравлении концентрированной уксусной к-той и при инфаркте миокарда.
Библиография Алексеев Г. А. и Берлинер Г. Б. Гемоглобинурии, М., 1972; Кассирский И. А. и Алексеев Г. А. Клиническая гематология, М., 1970; М о 1 1 i s о n P. L. Blood transfusion in clinical medicine, Philadelphia, 1972; Wintrobe М. M. Clinical hematology, Philadelphia, 1974.
Диагностика заболеваний по уровню гемоглобина F
В норме у взрослых уровень фетального белка определяется на уровне 1–2 от общего объема гемоглобина разного типа. Но при скрытых воспалительных процессах или опасных патологиях показатель начинает увеличиваться. Это один из признаков болезней костного мозга: он перестает вырабатывать клетки крови и его функцию частично берет на себя печень больного человека.
Анализ на фетальный гемоглобин лежит в основе диагностики лейкемии и многих заболеваний органов кроветворения. Биохимия крови в динамике показывает рост объема плодного белка и означает, что организм пациента вырабатывает незрелые клетки, не справляется с функцией.
Повышенный показатель указывает на острую гипоксию. Она может возникать при скрытых внутренних кровотечениях, патологии селезенки или аутоиммунных болезнях:
- наследственный сфероцитоз;
- серповидноклеточная анемия;
- талассемия.
С помощью F показателя врач оценивает эффективность переливания крови при травмах, онкологии, после тяжелой интоксикации, корректирует дальнейшее лечение.
Что такое сывороточный гемоглобин?
Тест на гемоглобин в сыворотке крови измеряет количество свободно плавающего гемоглобина в сыворотке крови. Сыворотка — это жидкость, оставшаяся после того, как красные кровяные клетки и элементы свертывания были удалены из плазмы крови. Гемоглобин — это тип белка, несущего кислород, который содержится в ваших эритроцитах.
Как правило, весь гемоглобин в вашем организме содержится в ваших красных кровяных телечках. Однако некоторые условия могут привести к тому, что часть гемоглобина будет в вашей сыворотке. Это называется свободным гемоглобином. Тест сывороточного гемоглобина измеряет этот свободный гемоглобин.
Врачи обычно используют этот тест для диагностики или мониторинга аномального распада эритроцитов. Если у вас была недавняя переливание крови, этот тест может контролировать реакцию переливания. Другой причиной может быть гемолитическая анемия. Если у вас есть этот тип анемии, ваши красные кровяные клетки ломаются слишком быстро. Это приводит к более высоким нормальным уровням свободного гемоглобина в крови.
Тест иногда называют кровяным гемоглобином.
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Что такое миоглобин
Миоглобин является кислородсвязывающим белком в мышечных клетках позвоночных, придающим мышцам отчетливый красный или темно-серый цвет. Это исключительно выражено в скелетных мышцах и сердечных мышцах. Миоглобин составляет 5-10% цитоплазматических белков в мышечных клетках. Поскольку аминокислотные изменения в полинуклеотидных цепях гемоглобина и миоглобина являются консервативными, как гемоглобин, так и миоглобин имеют сходную структуру. Кроме того, миоглобин представляет собой мономер, состоящий из одной полинуклеотидной цепи, состоящей из одной гем-группы. Следовательно, он способен связываться с одной молекулой кислорода. Таким образом, в миоглобине не происходит кооперативного связывания кислорода. Но аффинность связывания миоглобина является высокой по сравнению с таковой гемоглобина. В результате миоглобин служит белком, запасающим кислород в мышцах. Миоглобин выделяет кислород, когда мышцы функционируют. 3-D структура гемоглобина показана на фигура 2.
Рисунок 2: Миоглобин
Виды гемоглобина
Эмбриональный
С первых недель развития эмбриона в эмбриональном мешке образуются первые виды гемоглобина — Gover 1 и Gover 2. В норме к 12 недели развития плода эмбриональный гемоглобин полностью замещается фетальным.
Фетальный
Плодный гемоглобин (HbF) является следующим этапом в усовершенствовании гемоглобина. Он является основным видом на протяжении всей беременности и имеет более высокое сродство к кислороду, чем . К моменту родов его доля от общего количества гемоглобина составляет 50-80%. После рождения фетальный гемоглобин ребенка начинает усиленно распадаться и постепенно заменяется взрослым гемоглобином (HbA).
Взрослый
В первые месяцы жизни ребенка взрослый вид гемоглобина (HbA) полностью замещает плодный (HbF) и сохраняется на протяжении всей жизни человека. Имеют разные виды гемоглобина HbA:
- HbA1 — 98% от всего количества гемоглобина в крови
- HbA2 — 2%
- HbA3 — может встречаться в старых эритроцитах
- HbA1c — гликированный гемоглобин А
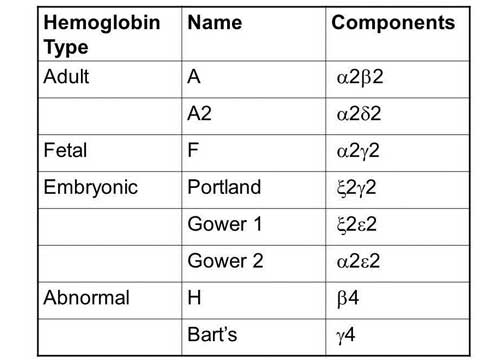 Виды гемоглобинов и цепи глобина в их составе
Виды гемоглобинов и цепи глобина в их составе
Патологические виды Hb
Мутации генов, ответственных за синтез альфа- и бета-цепей белка глобина, приводят к появления аномальных видов гемоглобина. В настоящее время известно более 100 аномальных гемоглобинов. В большинстве известных случаев способность гемоглобина переносить кислород и углекислый газ сохранена.
Сюда же можно отнести и гемоглобинопатии (например, серповидноклеточная анемия) и талассемии.
Какие опасные разновидности гемоглобина существуют?
Патологические виды гемоглобина у человека, которые приводят к различным болезням:
- Гемоглобин D-Пенджаб;
- Гемоглобин S – форма, обнаруженная у людей с серповидно-клеточной анемией;
- Гемоглобин С – эта форма вызывает хроническую гемолитическую анемию;
- Гемоглобин H – тип гемоглобина, образованный тетрамером β-цепей, который может присутствовать при α-талассемии.
ЖБ D-Пенджаб является одним из вариантов гемоглобина. Он так назван из-за его высокой распространенности в Пенджабском районе Индии и Пакистана. Это также самый распространенный аномальный вариант железосодержащего белка в Синьцзян-Уйгурском автономном районе Китая. Исследования показывают, что D-Пенджаб составляет более 55% от общего числа патологического гемоглобина.
Он был впервые обнаружен в начале 1950-х годов в смешанной британской и американской семье индийского происхождения из района Лос-Анджелеса, поэтому его иногда называют D Los Angeles. ЖБ D является наиболее распространенным вариантом данного вещества. Он появился в результате распространенности малярии в разных частях Азии.
Гемоглобин S возник в Западной Африке, где распространен больше всего. Он присутствует в меньшей степени в Индии и Средиземноморском регионе. Полиморфизм гена бета S указывает на то, что он возник из пяти отдельных мутаций: четырех в Африке и одного в Индии и на Ближнем Востоке. Наиболее распространенной является аллель, обнаруженная в Бенине в Западной Африке. Другие гаплотипы обнаружены в Сенегале и Банту.
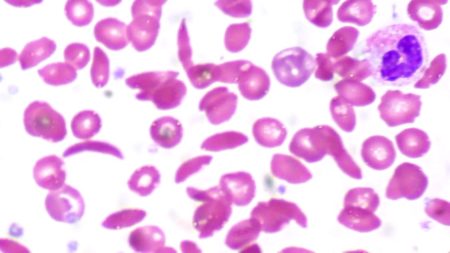 Серповидно-клеточная анемия
Серповидно-клеточная анемия
Железосодержащий белок C (Hb C) является одним из наиболее распространенных структурных вариантов гемоглобина. Люди со «здоровым» С (Hb C) фенотипически нормальны, тогда как пациенты с патологическим (Hb CC) могут страдать от гемолитической анемии. Хотя клинические осложнения, связанные с патологическим С, не являются серьезными.
Гемоглобин H вызывает тяжелое заболевание – альфа-талассемию. α-талассемия приводит к снижению продукции альфа-глобина, поэтому образуется меньше альфа-глобиновых цепей, что приводит к избытку β-цепей у взрослых и у новорожденных. Избыточные β-цепи образуют нестабильные тетрамеры, называемые гемоглобином H или HbH четырех бета-цепей. Избыточные γ-цепи образуют тетрамеры, которые слабо связываются с кислородом, поскольку их сродство к O2 слишком велико, поэтому оно не диссоциируется на периферии.
Виды гемоглобина и его функции
Помимо оксигемоглобина, в крови человека содержатся и другие виды гемоглобина. Важнейшим составляющим считается гликированный гемоглобин, который показывает количество глюкозы, содержащейся в крови. Образуется он в результате соединения данного пигмента с сахаром, помогает определить наличие сахарного диабета в организме, особенно на начальных стадиях развития.
Гликированный гемоглобин есть у каждого человека, только при сахарном диабете он значительно повышен. Анализ можно сдавать в любое время суток, его результативность не будет зависеть от инфекционных и иных заболеваний. Также он может определить уровень глюкозы в крови за последние несколько месяцев. Стоит понимать, что определить типы гемоглобина можно только при помощи лабораторных исследований.
Функции гемоглобина тесно связаны с дыхательным процессом, который происходит в три этапа:
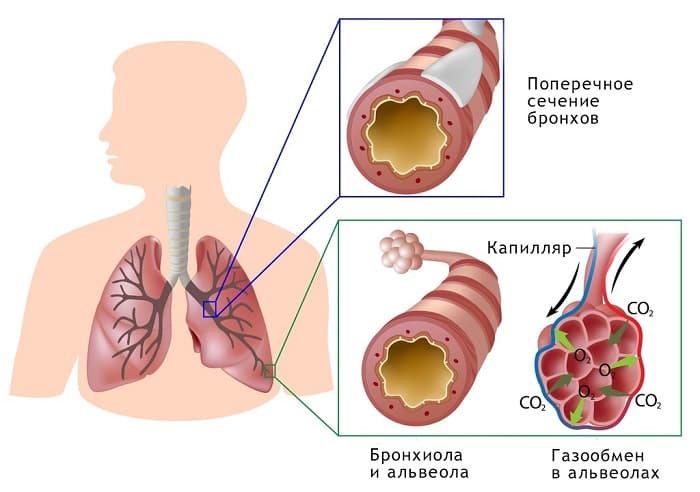
- Внешнее дыхание. Кислород вдыхается в тело за счет движения легких, а выводится из организма уже углекислый газ.
- Внутреннее дыхание. Кислород захватывает гемоглобин непосредственно в легких, преобразуется в оксигемоглобин и доставляется по всему организму, ко всем клеткам.
- Клеточное дыхание. Происходит кислородная реакция внутри клеток.
Без гемоглобина невозможно дыхание и насыщение организма кислородом. Также стоит учесть тот факт, что незначительное количество кислорода переносится кровью уже в растворенном виде, но основная часть приходится на гемоглобин.
При малейшем нарушении уровня гемоглобина, в организме наблюдается кислородное голодание клеток, которое может привести к появлению дистрофической симптоматики. Снижение уровня пигмента на протяжении длительного времени приводит к нарушениям в умственной деятельности. Также важная функция гемоглобина – буферная. Она обеспечивает своевременное удаление углекислого газа из клеток.
Патологические формы гемоглобина
- HbS — гемоглобин серповидно-клеточной анемии;
- MetHb — метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма обычно образуется спонтанно, в этом случае ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления ионов железа в клинике используют аскорбиновую кислоту и метиленовую синь;
- Hb-CO — карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни. Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи;
- HbA1С — гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени.
Физиология
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок , специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).
Строение
Гем — простетическая группа гемоглобина
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин, специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).
Виды
В крови человека содержатся разные виды гемоглобина:
- фетальный или плодный – этот вид белка содержится в крови новорожденного и уменьшается до 1% от общего количества гемоглобина в организме к пятому месяцу жизни ребенка;
- оксигемоглобин – содержится в клетках артериальной крови и связан с молекулами кислорода;
- карбоксигемоглобин – содержится в венозной крови и связан с молекулами углекислого газа, с которыми транспортируется в легкие;
- гликированный – соединение белка и глюкозы, циркулирует в крови. Этот вид белка выявляется в анализах на сахар;
- метгемоглобин – связан с химическими веществами, его рост в крови может говорить об отравлении организма;
- сульфгемоглобин – эта молекула гемоглобина появляется в крови только при приеме некоторых препаратов. Допустимый уровень гемоглобина этого типа – не больше 10%.
Виды гемоглобина, а также определение, какое его количество находится в крови, выявляются только путем лабораторной диагностики.
Что такое миоглобин?
Миоглобин представляет собой белок мономера глобина, который проявляет вторичную структуру. Он состоит из одной полинуклеотидной цепи, которая состоит из 153 остатков. Он имеет единственную группу heam, присоединенную к своей единственной полипептидной цепи. Таким образом, одна молекула кислорода может связываться с ним. Но его связывающая способность выше, чем у гемоглобина, поэтому он служит в качестве запасающего кислород белка, который высвобождается во время функционирования мышц. Он содержится в мышечных клетках и обеспечивает их кислородом по требованию. Помогает организму в голодных условиях кислорода, особенно в анаэробных условиях. Он также регулирует температуру тела. Миоглобин не имеет никакого типа.
Нормы гемоглобина в крови по возрастам
Гемоглобин в крови и его значение для организма человека

Что такое гемоглобин?
Гемоглобином называют железосодержащее белковое соединение, которое, как можно сделать выводы из состава, отвечает за поступление к органам железа, фолиевой кислоты и меди (последние помогают усваиваться лучше железу).
Нормы в крови гемоглобина у взрослых зависит от их окружающей среды, возраста и пола. К примеру, для женского пола нормой считается 120-140 (и даже иногда 160) г/л. А вот нормальный уровень гемоглобина у мужчин не должен превышать отметку в 130-150 г/л.
При этом, для людей пожилого возраста допускается понижение вышеописанных параметров на 5 г/л. Такая норма для пенсионеров считается довольно естественной и, как правило, не вызывает опасений. Кроме того, у беременных может наблюдаться снижение гемоглобина до 110 г/л. Это происходит из-за увеличения объёма крови в данный период вынашивания ребёнка.
У жителей высокогорных районов страны, а также людей, которые занимаются активными видами спорта или тяжёлым физическим трудом на свежем воздухе, завышенный уровень в крови гемоглобина считается также нормальным. Кроме того, некоторое завышение нормы считается вполне естественным и для «опытных» курильщиков.
При понижении или повышении уровня гемоглобина человек быстро утомляется, у него появляется отдышка, нарушается сон и пропадает аппетит. При первый признаках необходимо обратиться в больницу для сдачи определённых анализов, основным из которых является сдача крови. После этого, врач назначит лечение. Если же вовремя не отреагировать на первые симптомы, то можно значительно ухудшить состояние здоровья.
Для нормализации в крови уровня гемоглобина рекомендуется соблюдать правильный рацион питания, выбирая только полезные продукты. Также, следует соблюдать водный режим, хорошо высыпаться и делать передышки на отдых, занимаясь тяжёлым физическим трудом.
В особо тяжёлых случаях, врач обязан назначить Вам медикаментозное лечение. Ведь довольно часто, повышение или понижение гемоглобина в крови является свидетельством того, что организм подвергся атаке паразитов, вирусов или инфекции. В данном случае, для нормализации уровня следует бороться с болезнью.
Таблицы по нормам содержания гемоглобина в крови
| Возраст ребенка | ребенок от 0 до 2 лет | 2-6 лет | 6-12 лет | 12-15 лет |
| Гемоглобин/литр крови | 110,0–135,0 г/л | 110,0–140,0 г/л | 110,0–145,0 г/л | 115,0–150,0 г/л |
Значения гликированного гемоглобина в крови больных сахарным диабетом
HbA1c 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 4,9 Glucose 3,6 3,8 4,0 4,2 4,4 4,6 4,8 5,0 5,2 5,4 HbA1c 5,0 5,1 5,2 5,3 5,4 5,5 5,6 5,7 5,8 5,9 Glucose 5,6 5,8 6,0 6,2 6,4 6,6 6,8 7,0 7,2 7,4 HbA1c 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 6,8 6,9 Glucose 7,6 7,8 8,0 8,2 8,4 8,6 8,8 9,0 9,2 9,4 HbA1c 7,0 7,1 7,2 7,3 7,4 7,5 7,6 7,7 7,8 7,9 Glucose 9,6 9,8 10,0 10,2 10,4 10,6 10,8 11,0 11,2 11,4 HbA1c 8,0 8,1 8,2 8,3 8,4 8,5 8,6 8,7 8,8 8,9 Glucose 11,6 11,8 12,0 12,2 12,4 12,6 12,8 13,0 13,2 13,4 HbA1c 9,0 9,1 9,2 9,3 9,4 9,5 9,6 9,7 9,8 9,9 Glucose 13,6 13,8 14,0 14,2 14,4 14,6 14,8 15,0 15,2 15,4 HbA1c 10,0 10,1 10,2 10,3 10,4 10,5 10,6 10,7 10,8 10,9 Glucose 15,6 15,8 16,0 16,2 16,4 16,6 16,8 17,0 17,2 17,4 HbA1c 11,0 11,1 11,2 11,3 11,4 11,5 11,6 11,7 11,8 11,9 Glucose 17,6 17,8 18,0 18,2 18,4 18,6 18,8 19,0 19,2 19,4 HbA1c 12,0 12,1 12,2 12,3 12,4 12,5 12,6 12,7 12,8 12,9 Glucose 19,6 19,8 20,0 20,2 20,4 20,6 20,8 21,0 21,2 21,4 HbA1c 13,0 13,1 13,2 13,3 13,4 13,5 13,6 13,7 13,8 13,9 Glucose 21,6 21,8 22,0 22,2 22,4 22,6 22,8 23,0 23,2 23,4
источник
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии. Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.