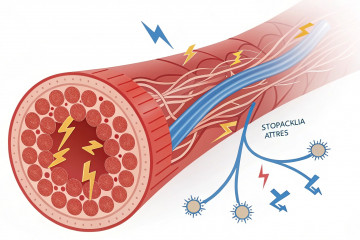
Как работает иммунотерапия рака: механизмы, мишени и группы препаратов
Содержание:
- Плюсы и минусы иммунотерапии при онкологии
- Китруда/Keytruda (пембролизумаб)
- Тецентрик (атезолизумаб) — иммунотерапия трижды негативного рака молочной железы
- ФДТ при метастатическом поражении кожных покровов
- Пробы и ошибки: первые годы иммунотерапии
- Основные группы препаратов применяемых при иммунотерапии
- Применение метода при лечении разных видов онкологии
- Новая надежда. Станет ли иммунотерапия панацеей?
- Процесс терапии
- Кейтруда
- Механизм действия
- Дабрафениб
- Виды препаратов
- Задачи и разновидности иммунотерапии при раке
- Положительные факторы иммунопрепаратов
Плюсы и минусы иммунотерапии при онкологии
Иммунотерапия– это новейший методлечения рака. Она достаточно эффективна, увеличивает шансы на излечивание. Группа американских исследователей провела эксперимент, в ходе которого противоопухолевая вакцина была опробована на мышах. Инъекция вводилась непосредственно в опухоль. 87 из 90 грызунов полностью победили рак после такого эксперимента.
У иммунотерапии имеется ряд преимуществ. Используется для лечения как твердых, так и гематологических опухолей. Представляет собой форму терапии:
- предназначенную для реактивации иммунного ответа на раковые клетки;
- использующую агенты, которые модулируют иммунные контрольные точки;
- укрепляющую иммунитет и стимулирующую его распознавать раковые клетки.
Такая терапия практически безболезненна. Она подходит даже для пациентов, которым противопоказана химиотерапия или лучевая терапия.
Наряду с активацией иммунной системы к опухолям иммунотерапия вызывает побочные эффекты, большинство из которых являются случаями интерстициального нефрита. Существуют данные о редких случаях массовой протеинурии и нефротического синдрома. Наиболее частыми побочными эффектами являются лихорадка, волнение и усталость. Может наблюдаться сердечная недостаточность, которая проходит после отмены используемого препарата. А тошнота, рвота и выпадение волос при таком лечении не наблюдаются.
Китруда/Keytruda (пембролизумаб)
Препарат Китруда также является ингибитором контрольной точки. Он одобрен для лечения метастатического или неоперабельного рака, в клетках которого выявляется микросателлитная нестабильность (microsatellite instability, MSI), либо дефицит экспрессии одного или нескольких белков системы восстановления несоответствия ДНК (dMMR).
Имеются доказательства того, что Китруда может быть эффективна при лечении метастатического HER2-позитивного рака, когда препарат комбинируют с анти-HER2 таргетной терапией (например, с трастузумабом), если в опухоли присутствуют гиперэкспрессия PD-L1 и высокий уровень TILs (опухоль-инфильтрирующие лимфоциты).
Тецентрик (атезолизумаб) — иммунотерапия трижды негативного рака молочной железы
Тецентрик (атезолизумаб) одобрен для лечения трижды негативного рака молочной железы (как у женщин, так и у мужчин). Трижды негативный рак означает, что на поверхности клеток этой опухоли нет рецепторов эстрогена, прогестерона и HER2-рецептора. На сегодняшний день препарат также одобрен для лечения рака мочевого пузыря и неоперативного немелкоклеточного рака легкого 3 стадии.
Тецентрик — это антитело к PD-L1, блокирует этот белок. PD1 (англ. Programmed cell death 1; CD279) — мембранный белок надсемейства иммуноглобулинов, играет роль в клеточной дифференцировке иммунных клеток. PD1 может присутствовать на поверхности некоторых раковых клеток, он препятствует атаке иммунной системы. Блокируя PD-L1, препарат, по сути, «срывает маску» с злокачественной клетки, тем самым позволяет иммунной системе её атаковать.
Тест по определению эффективности Тецентрика
Перед тем, как использовать препарат, нужно тестирование (анализ VENTANA PD-L1), чтобы выяснить, будет ли эффективен Тецентрик. Опухоль с высокой экспрессией PD-L1 лучше всего реагируют на этот препарат. Тест считается положительным, когда окрашенные PD-L1 опухоль-инфильтрирующие лимфоциты покрывают один или более процентов площади опухоли.
Ещё раз напоминаю: Тецентрик показан на сегодняшний день только пациентам с трижды негативного рака молочной железы.
Пути введения
В исследованиях пациенты получали Тецентрик по 840 мг (или плацебо) путем внутривенной инфузии в 1 и 15 дни (цикл 28 дней). Абраксан (100 мг/м2) вводили внутривенно в 1, 8 и 15 дни (цикл 28 дней). Лечение продолжали до тех пор, пока не наблюдалось прогрессирование заболевания.
Побочные эффекты
Следующий побочные эффекты наиболее часто встречались при использовании комбинации Тецентрик и Абраксан (у 20 % пациентов):
- Выпадение волос
- Периферическая невропатия
- Общая слабость
- Тошнота и рвота
- Диарея, запор
- Анемия
- Кашель
- Головные боли
- Низкий уровень типа лейкоцитов
- Потеря аппетита
Неблагоприятные реакции/осложнения
Менее распространенные, но более серьезные побочные эффекты могут включать:
- Пневмонит (воспаление легких)
- Гепатит (воспаление печени)
- Колит (воспаление толстой кишки)
- Нарушения эндокринной системы, такие как гипотиреоз или недостаточность надпочечников
- Инфекционные заболевания
- Аллергические реакции
Противопоказания
Комбинация Тецентрик и Абраксан не должна применяться во время беременности (врожденные пороки развития). Для женщин в пременопаузе следует использовать эффективные противозачаточные средства (кроме гормональных препаратов).
Цена иммунотерапии
К сожалению, стоимость многих новые препараты, в том числе препараты иммунотерапии, в настоящее время очень высока.
ФДТ при метастатическом поражении кожных покровов
Наряду с первичными и рецидивными злокачественными опухолями особое место занимает метастатическое поражение кожных покровов. По данным литературы, частота метастазов рака внутренних органов в кожу колеблется от 0,29 до 3,3%. Из метастатических злокачественных опухолей кожи наибольшую группу составляет рак молочной железы. Метастазы чаще локализуются на грудной стенке вблизи от первичной опухоли и преимущественно развиваются после хирургического лечения.
Основным методом лечения больных с внутрикожными метастазами рака молочной железы остается химио или гормонотерапия с многократным повторением курсов лечения. Второй по частоте причиной метастазов в кожу после рака молочной железы является меланома. Кожные и подкожные метастазы появляются примерно в 2-10% случаев. Метастазы могут быть единичные или множественные, располагаться вблизи первичного очага или отдаленно от него.
При лечении внутрикожных метастазов меланомы возможно применение хирургического лечения, лучевой терапии, комбинированного лечения. Однако при появлении новых очагов болезни в коже их применение становится сомнительным. Рост метастазов на фоне неэффективности традиционных методов лечения ухудшает прогноз жизни больных, способствует появлению впоследствии болевого синдрома, отека, интоксикации, что отрицательно сказывается на общем и психоэмоциональном состоянии больных, и снижения качества их жизни.
Именно такие пациенты нуждаются в лечении другими альтернативными методами, обладающими высокой противоопухолевой эффективностью. Одним из таких методов является ФДТ. Группой авторов проведена ФДТ с отечественными фотосенсибилизаторами у 36 пациентов с внутрикожными метастазами. При применении пролонгированной ФДТ у больных с внутрикожными метастазами рака молочной железы и меланомы полная регрессия опухолей получена в 39,3% и 38% соответственно, частичная – в 46% и 52,4%. У всех больных на фоне ранее проводимой традиционной терапии отмечена резистентность опухоли к традиционному лечению.
Таким образом, проведение ФДТ в значительной степени влияет на улучшение качества жизни этой сложной категории пациентов.
Пробы и ошибки: первые годы иммунотерапии
«Иммунотерапия пострадала от множества чрезмерно раздутых ожиданий», – говорит доктор О‘Доннелл-Торми, ссылаясь, в частности, на характеристику моноклональных антител как «волшебной пули против рака», данную еще в 1970 году. К сожалению, вскоре после этого «волшебные пули» оказались по большей части «холостыми выстрелами».
«Когда не удавалось достичь результата, – говорит она, – все теряли интерес к этому направлению в целом».
Ранняя история иммунотерапии была отмечена начинаниями и ошибками – и, пожалуй, ошибок было даже больше. После осечки «волшебной пули» 1970-х годов в 1980-х годах потерпело неудачу первое моноклональное антитело, испытанное против лимфомы. Однако гораздо позже в том же десятилетии для лечения меланомы был одобрен интерферон гамма. В 1991 году был идентифицирован первый опухолевый антиген, который дал некоторым исследователям новую надежду на то, что мы действительно можем использовать возможности иммунной системы человека непосредственно для атаки на раковые клетки.
В то время как первое успешное моноклональное антитело (Ритуксимаб) было окончательно одобрено в 1997 году, в 1990-х годах также был отмечен ряд неудач с противораковыми вакцинами, которые многие считали мощным новым направлением профилактики рака. За выдающимся исключением вакцины против вируса папилломы человека, которая продемонстрировала способность предотвращать связанные с ВПЧ раковые заболевания, истории успеха в области иммунотерапии все еще были малочисленными и редкими на протяжении многих лет.
Переносясь вперед ко второму десятилетию 21-го века, иммунотерапия снова стала, по словам доктора О‘Доннелл-Торми, «новым фаворитом онкологии».«В 1991 году был идентифицирован первый опухолевый антиген, который дал новую надежду на то, что мы действительно можем использовать возможности иммунной системы…»
В 2011 году ингибитор CTLA-4 в качестве блокатора контрольной точки был одобрен для лечения метастатической меланомы – это был первый вид лечения, который влиял на общую выживаемость при поздних стадиях меланомы. С тех пор FDA одобрила 13 различных иммунотерапевтических средств для лечения 12 видов рака.
«Один научный журнал в 2013 году назвал (иммунотерапию) прорывом года, и она была в числе лучших достижений Американского общества клинической онкологии в 2016 году», отмечает доктор О‘Доннелл-Торми. «На недавней конференции Американского общества клинической онкологии в июне она была темой многих сообщений – большой шаг вперед по сравнению с тем, что было 10 лет назад, когда иммунотерапия была оттеснена в сторону, в небольшой конференц-зал без посетителей на последний день конференции.»
Ирония того, что иммунотерапия была названа «прорывом» в 2013 году, не ускользнула от доктора Ганди, которая повторяет напоминание доктора О‘Доннелл-Торми о том, что иммунотерапия никоим образом не является новой концепцией в лечении рака. Д-р Ганди, однако, проводит различие между активной и пассивной иммунотерапией – последняя, в частности, у нее и ее коллег-онкологов теперь вызывает большой интерес.
«Активная» иммунотерапия или попытка стимулировать ответ на опухоль включает в себя применение цитокиновых терапевтических (и) противораковых вакцин, которые на протяжении многих лет интересуют многих исследователей в области различных типов опухолей», – говорит д-р Ганди.
«Пассивная» иммунотерапия, в противоположность, является блокирующим подавлением иммунного ответа в опухоли или (ее) микроокружении. (Она) является более новой концепцией в лечении онкологии и началась с разработки антител против CTLA-4, а в последнее время переключилась на разработку антител против PD-1 и PD-L1».
Эти специфические антитела производят так называемую блокировку контрольных точек, это инструмент, который явно «активизировал» недавний энтузиазм по поводу новых иммунотерапевтических средств для лечения рака.
Основные группы препаратов применяемых при иммунотерапии
Вот основные группы препаратов, которые используются во время проведения иммунотерапии:
- Цитокины (Интерлейкин-2 и Интерферон-). Препараты этой группы стимулируют широкую реакцию иммунной системы.
- Вакцинная иммунотерапия. Вакцинация стимулирует иммунитет организма пациента.
- Ингибитор CTLA4. При раке кожи (меланоме) благодаря использованию такого средства продолжительность жизни больного составляет более 10 лет.
- Это белковый рецептор, сдерживающий иммунный ответ на раковые клетки.
- Ингибитор PDL1. Отличные результаты показал при лечении рака головы и горла. В настоящий момент активно применяется при лечении опухолей мочевого пузыря.
Иммунотерапия рака включает в себя Цитокины
Современные исследования ведутся в направлении нахождения уникального препарата иммунотерапии, которая будет помогать при лечении различных видов рака. Для этого понадобятся годы работы, так как важным моментом в лечении остается риск серьезных побочных эффектов.
Также ведутся наблюдения по совместному использованию иммунотерапии и стандартных способов лечения рака – химиотерапия, таргетные препараты.
Применение метода при лечении разных видов онкологии
Антигенспецифическая терапия активно используется врачами при онкологическом образовании в печени, коры головного мозга, пищевода, при глиобластоме. Применяется при опухоли в тканях мочевого пузыря, поджелудочной или предстательной железы, в районе шейки матки, груди, желудка и т.д. Врачи индивидуально подбирают курс терапии. На выбор лекарства влияет физическое состояние больного, медицинские показания, вид и стадия патологии.
Рак лёгких
Онкология в тканях лёгкого занимает одно из первых мест по диагностике. Мужчины страдают недугом чаще, чем женщины. Болезнь отличается высокой смертностью среди больных.
В организме присутствует небольшое количество раковых антигенов, на которые могут воздействовать иммунопрепараты. Это результативно используется в лечении заболевания. Особенно данный способ показывает высокую результативность во время диагностики немелкоклеточной онкологии, при мелкоклеточном раке лёгких процент выздоровления ниже.
В терапевтических мерах применяют перечисленные виды:
- Использование моноклональных антител для борьбы со злокачественным новообразованием;
- Применение ингибиторов, подавляющих защитные реакции организма;
- Назначение противоопухолевых препаратов;
- Клеточная стимуляция иммунитета, которая сопровождается лечебным перемещением Т-лимфоцитов.
В медицинской практике есть примеры появления побочных эффектов, поэтому терапия проходит в стационаре под контролем врача.
Рак молочной железы
Онкология молочной железы стоит на первых местах среди женских заболеваний злокачественного характера. Диагностируется в 12% всех патологий. При РМЖ повышается продуцирование белка-рецептора HER-2 – это приводит к стремительному делению злокачественных патогенов. Рак груди демонстрирует негативные онкологические свойства, заложенные на генетическом уровне.
Иммунотерапия применяется при наличии белка HER-2 в составе новообразования. Лекарство вводят в ткани опухоли при помощи тонкой иглы – это позволяет не травмировать здоровые ткани. Побочные эффекты при данном методе лечения практически не диагностируются, поэтому препараты можно использовать совместно с другими и в течение длительного периода времени.
У больной отмечается замедление роста опухоли, раковые клетки постепенно погибают. Женщина может прожить более 5 лет и вернуться к прежней жизни.
Другие виды онкологии
Онкологический процесс может начаться в любом органе – это зависит от многих факторов. Бывает рак простаты, кожи, крови и т.д. Опухоль в области головного мозга негативно влияет на зрение, память и координацию. Также наблюдаются другие тяжёлые симптомы, ухудшающие самочувствие человека. Определить болезнь на ранних сроках сложно из-за отсутствия выраженных признаков. Первые симптомы появляются при метастазах в другие органы тела.
Иммунотерапия применяется при следующих видах онкологии:
- При меланоме использование противоопухолевых антигенов помогает снизить показатели раковой интоксикации. Стимулирование работы защитных функций помогает остановить распространение меланомы по телу. В терапевтических целях применяют Кейтруда, Опдиво и другие.
- При онкологическом образовании в тканях желудка до 3 стадии используют хирургический метод лечения. Иммунотерапия требуется на последней неоперабельной стадии, чтобы приостановить распространение метастаз и купировать тяжёлые симптомы патологии. Применяют – Трастузумаб, Рамуцирумаб и т.п.
- При раке почек используют лекарственные препараты из группы цитокинов, ингибиторы контрольных точек.
Метод доказал результативность в лечении ряда болезней злокачественного характера. Выбор препарата зависит от вида опухоли и самочувствия больного.
Новая надежда. Станет ли иммунотерапия панацеей?
Как и у других методов лечения рака, у иммунотерапии есть свои ограничения. Несмотря на то, что в ряде случаев пациенты дают очень хороший ответ на терапию ингибиторами иммунных контрольных точек, в 60% случаев либо развивается приобретенная, либо наблюдается первичная резистентность к анти-PD-1 или анти-CTLA-4 препаратам: опухоль просто не реагирует на лечение или быстро приспосабливается и учится его «обходить».
Кроме PD-1, PD-L1/2, CTLA-4, CD28 и B7 на поверхностях Т-клеток и опухолевых клеток есть масса других ко-рецепторов, действие которых пока не изучено так хорошо, как работа контрольных точек, но они также влияют на иммунный ответ. Одно из направлений работы — влияние на эти ко-рецепторы.
Кроме того, терапия ИИКТ дополняется введением вакцин, цитокинов, бета-блокаторов — и такой подход тоже хорошо работает в ряде случаев.
CAR-T терапия все еще является крайне дорогой и пока еще только переходит в стадию коммерческого использования: ведутся разработки в научных группах Эшхара и Розенберга, других исследователей — каждая из групп создают особые виды CAR-Т с направленным действием против определенного вида рака. Но пока это только исследования, проверки и испытания. Пройдет несколько лет, прежде чем это превратится в отработанный массовый способ лечения — но и тогда нельзя будет давать 100% гарантий.
Но пока ученые проводят исследования, врачи внедряют экспериментальные схемы лечения с использованием тех достижений, что уже есть. И самый заметный эффект дает сочетание иммунотерапии с классическими «тремя столпами» онкологии: лучевой и химиотерапией, хирургией. При комбинировании этих методов всегда получается синергия: вместе они работают эффективнее, чем по очереди.
Если стандартно до сих пор иммунотерапевтические препараты включали в третью, в пятую линию (то есть очередь) терапии, то сейчас врачи движутся к тому, чтобы назначать их сразу, вместе с химиотерапией и терапией таргетными моноклональными антителами: такие пациенты часто показывают более хорошую динамику и в итоге живут дольше.
В России уже зарегистрированы все основные иммунопрепараты. Проблема, правда, что для каждого из них Минздрав отдельно оговаривает показания. То есть в оригинальной инструкции к препарату может быть прописано, например, девять разных видов рака, при котором препарат можно назначать, а у нас в стране он зарегистрирован только для шести из них. И так с каждым препаратом. В итоге, пока около 50% опухолей еще не включены в этот список. Соответственно, в рамках лечения по ОМС врач может выписать эти препараты далеко не всем пациентам.
К тому же врачи бюджетных государственных клиник строго ограничены протоколами лечения. И если в протоколе ингибиторы контрольных точек прописаны только на 3 линии, на 3 месте после двух линий стандартной «химии», то выписать их в первую очередь врач просто не имеет права, даже если считает, что пациенту это поможет.
Ну и частая проблема — отсутствие квалификации. Метод, хоть и успел проявить себя, пока для многих врачей в стране еще новый. Препараты все западные, и доходят до нас с опозданием на 2-3 года. А, учитывая, что активно применяется иммунотерапия всего несколько лет, у многих еще нет опыта работы с ними. Кроме того, использование иммунотерапии требует специфических знаний.
В частной медицине мы не ограничены бюджетом. Если в «Медицину 24/7» обращается пациент с такой опухолью, для которой еще не зарегистрирован препарат иммунотерапии, мы предлагаем ему пройти молекулярно-генетическое исследование. По результатам становится понятно, отреагирует ли его опухоль на иммунопрепарат. Если да — врач имеет полное право ее назначить. Поэтому в нашем стационаре мы применяем иммунотерапию почти по всем видам рака — она дает очень хорошие результаты. Даже пациенты на III-IV стадии показывают улучшения. Иммунопрепараты дают нам возможность продлять людям жизнь, даже в случаях, которые считались безнадежными.
Общее и в частных, и в государственных клиниках — это сами пациенты. Они не всегда хорошо понимают, что это за метод, как он работает, отсюда недоверие. Мы надеемся, эта статья помогла разобраться и понять, что иммунотерапия сегодня совершенно заслуженно находится в фокусе пристального внимания онкологов. Судя по результатам, она уже готова встать на один уровень с классическими методами. Страшная болезнь отступит еще на шаг дальше.
Процесс терапии
Терапия онкологии во многом зависит от состояния иммунитета. Применение искусственных видов лечения показывает временный результат, который возможно закрепить естественными ответами защитной системы организма. Запуская иммунный ответ организма, применяют специфические биологические средства. Препараты тормозят рост опухоли, возрождая защитные свойства организма.
В качестве таких препаратов используют моноклональные антитела, которые соединяются с внутренними антигенами и начинают совместную борьбу с болезнью, и цитокины, стимулирующие ответ иммунитета на формирование опухоли. Антигены блокируют доступ питательных веществ к злокачественному новообразованию. Это приводит к остановке дальнейшего разрастания опухоли.
Вещество готовят индивидуально, используя биоматериал опухоли. Затем идет подготовка вакцины с тщательной проверкой. Курс терапии занимает несколько месяцев. Человек находится под контролем лечащего врача – это позволяет проконтролировать состояние болезни.
Кейтруда
Кейтруда (другие названия: Пембролизумаб, MK-3475) — инновационный препарат, который был одобрен FDA (Американским управлением по надзору за качеством пищевых продуктов и медикаментов) в сентябре 2014 года, и в настоящее время уже достаточно широко применяется для лечения меланомы на поздних стадиях.
В 2014 году Кейтруда получила статус «приоритетное рассмотрение» и «прорыв в медицине». Это означает, что Пембролизумаб был включен в группу лекарственных средств, способных повысить эффективность и безопасность лечения редких и серьезных заболеваний. Именно поэтому препарат был так быстро одобрен и внедрен в клиническую практику. Обычно это происходит намного дольше.
Как действует Кейтруда?
Препараты для иммунотерапии меланомы и других злокачественных опухолей существуют уже достаточно давно. Но они всегда имели низкую эффективность, и до недавнего времени ученые не знали, как справиться с этой проблемой.
Задача иммунотерапии — активировать иммунную систему больного, заставить её атаковать и уничтожать раковые клетки. Долгое время препятствием для достижения этой цели становился белок PD-1. Это иммуноглобулин, молекулы которого встроены в клеточные мембраны. Он играет роль в дифференцировке иммунных клеток.
Белок PD-1 блокирует работу иммунной системы. Он не дает Т-лимфоцитам распознавать и уничтожать раковые клетки.
Кейтруда содержит моноклональные антитела, которые блокируют PD-1. Препарат помогает убрать «тормоз», благодаря чему лимфоциты приобретают способность атаковать опухолевую ткань.
Когда применяется этот препарат?
Показания к применению Кейтруды:
- метастазирующая меланома на поздних стадиях;
- неоперабельная меланома;
- отсутствие эффекта от лечения другими препаратами.
Насколько эффективна Кейтруда?
В Калифорнийском Университете в Лос-Анджелесе было проведено исследование, в котором приняли участие 173 человека с диагностированной прогрессирующей меланомой. Их разделили на две группы. В одной из них пациенты получали стандартную дозу препарата 2 мг на килограмм массы тела через каждые 3 недели. Во второй группе доза была увеличена в 5 раз (10 мг/кг).
У 24% пациентов, получавших препарат в дозе 2 мг/кг, опухоль уменьшилась более чем на треть. Повторный рост меланомы не отмечался, а эффект препарата сохранялся от 1,4 до 8,5 месяцев (в отдельных случаях — дольше).
Безопасна ли Кейтруда?
Второе исследование было проведено с участием 411 пациентов, которые имели прогрессирующую меланому и принимали Кейтруду. При этом тяжелые побочные эффекты со стороны кишечника, легких и печени отмечались редко.
Чаще всего у больных возникали такие побочные эффекты, как повышенная утомляемость, кашель, тошнота, сыпь, кожный зуд, снижение аппетита, запор, диарея, боли в суставах (источник данных об исследованиях — https://www.medicalnewstoday.com/articles/282101.php).
Механизм действия
Основной особенностью механизма действия препаратов, применяемых для И., является то, что они осуществляют свое действие через иммунокомпетентные клетки (или дополнительные факторы иммунитета — макрофаги, систему комплемента). Каждый препарат, применяемый для И., помимо главного направления действия (табл.), обладает и другими эффектами (напр., кортикостероиды, механизм действия которых на иммунную систему заключается в нарушении взаимодействия между лимфоцитами и макрофагами, обладают также противовоспалительным действием; иммуноглобулины, помимо своего основного заместительного эффекта, оказывают также стимулирующее действие на синтез антител и т. д.). Для характеристики всех средств, применяемых для И., главными являются два параметра: 1) направление действия — стимуляция, подавление или замещение иммунной системы; 2) точки приложения действия — Т- и В-лимфоциты.
Так, стимулирующая И. может усиливать скорость пролиферации и дифференцировки иммунокомпетентных клеток, причем этот эффект может быть как специфическим — вовлечение только клонов клеток, способных реагировать на данный антиген (туберкулин и др.), так и неспецифическим, когда в реакцию вовлекается значительная часть популяции иммунокомпетентных клеток. При этом некоторые препараты стимулируют преимущественно Т-лимфоциты (левомизол и др.), другие — B-лимфоциты (полиадинил: полиуридиновая к-та и др.). Подавляющая терапия может воздействовать как на отдельные клоны клеток (индукция толерантности, гипосенсибилизация), так и на целые популяции (иммунодепрессия). Иммунодепрессанты могут оказывать преимущественное действие на Т-лимфоциты (напр., АЛС) или на В-лимфоциты (напр., цитозин-арабинозид). Особым видом И. является пассивная И., когда реципиенту, нуждающемуся в соответствующем лечении, переносят готовые защитные факторы либо специфически сенсибилизированные к определенному антигену клетки или иммунную сыворотку, либо клетки, замещающие деятельность целой популяции (Т или В), или иммуноглобулины. Один из типов И.— адоптивная И.— с помощью продуктов клеток сенсибилизированных доноров или просто с помощью экстрактов иммунокомпетентных клеток клетки реципиента наделяются иммунными свойствами (так, напр., при введении «фактора переноса» — экстракта клеток, реагирующих на определенный антиген, — клетки реципиента, ранее не реагировавшие на этот антиген, восстанавливают свою реактивность).
Дабрафениб
Дабрафениб (Тафинлар) — новый препарат для иммунотерапии меланомы на поздней стадии, относящийся к группе ингибиторов белка BRAF. Он был одобрен FDA в 2014 году.
Как действует Тафинлар?
Дабрафениб, как и Зелбораф, блокирует белок, который образуется в результате мутации гена BRAF.
Согласно статистике, около 50% всех больных меланомой на поздних стадиях имеют мутацию этого гена. Её распространенность зависит от расположения опухоли:
- больные с меланомой на коже имеют мутацию более чем в 50% случаев;
- меланома слизистых оболочек содержит мутировавшие клетки в 5% случаев;
- меланома глаза никогда не сопровождается такой мутацией.
Когда применяется Дабрафениб?
Показания к применению препарата:
- метастазирующая меланома на поздних стадиях;
- неоперабельная меланома.
При применении Дабрафениба не назначаются другие виды лечения меланомы, такие как иммунотерапия, лучевая терапия, химиотерапия.
В 2012 году в журнале «Ланцет», — одном из самых авторитетных медицинских изданий, — были опубликованы результаты сравнения эффективности Дабрафениба и Дакарбазина — препарата, который наиболее часто используется для лечения меланомы. Выживаемость пациентов, принимавших Дабрафениб, оказалась существенно выше.
В 2014 году ученые опубликовали обновленные результаты исследования. В течение 2-х лет выживаемость пациентов, принимавших Дабрафениб, составила 45%, а тех, кто получал Дакарбазин — 32%.
Чаще всего при приеме Дабрафениба отмечаются такие побочные эффекты, как утолщение кожи (гиперкератоз), лихорадка, головная боль, боли в суставах, потеря слуха, папилломы кожи. Наиболее тяжелые возможные побочные эффекты, которые встречаются редко: падение артериального давления, тяжелые ознобы, обезвоживание, тяжелые нарушения функции почек, повышение уровня сахара крови. Перед назначением препарата всегда проводят исследование, которое помогает убедиться, что у больного имеется мутация гена BRAF. Широко применяется тест THxID BRAF Kit.
Европейская онкологическая клиника сотрудничает с израильскими, европейскими и американскими врачами, которые накопили значительный опыт в лечении иммунопрепаратами последнего поколения.

Виды препаратов
Злокачественные опухоли молочной железы могут обладать разными молекулярно-генетическими свойствами, и это определяет их восприимчивость к тем или иным методам лечения. На поверхности некоторых клеток увеличено количество белка-рецептора HER2. Его активация заставляет раковые клетки размножаться. Рак груди является HER2-позитивным примерно у каждой пятой пациентки.
В настоящее время американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрены для клинического применения три иммунопрепарата (их же относят к таргетным препаратам) из группы моноклональных антител: трастузумаб (герцептин), пертузумаб (перьета), трастузумаб эмтанзин (кадсила). Другие виды иммунотерапии пока проходят клинические испытания.
Задачи и разновидности иммунотерапии при раке
Назначение иммунных препаратов при раке необходимо для:
- Воздействия на опухоль и ее уничтожения;
- Уменьшения побочного влияния противоопухолевых средств (иммуносупрессии, токсического действия химиопрепаратов);
- Профилактики повторного опухолевого роста и образования новых неоплазий;
- Предупреждения и ликвидации инфекционных осложнений на фоне иммунодефицита при опухоли.
Иммунные препараты избираются в соответствии с данными анализов о деятельности иммунной системы, которые правильно интерпретировать может только специалист в области иммунологии.
В зависимости от механизма и направленности действия иммунных препаратов различают несколько видов иммунотерапии:
- Активная;
- Пассивная;
- Специфическая;
- Неспецифическая;
- Комбинированная.
Вакцина способствует созданию активной иммунной защиты против раковых клеток в условиях, когда организм сам способен обеспечить правильный ответ на вводимый препарат. Иными словами, вакцина дает лишь толчок для развития собственного иммунитета к конкретному опухолевому белку или антигену. Устойчивость к опухоли и ее уничтожение при вакцинации невозможны в условиях иммуносупрессии, провоцируемой цитостатиками или облучением.
Иммунизация в онкологии включает не только возможность создания активного собственного иммунитета, но и пассивный ответ за счет применения готовых факторов защиты (антитела, клетки). Пассивная иммунизация в отличие от вакцинации возможна у тех больных, которые страдают иммунодефицитным состоянием.
Таким образом, активная иммунотерапия, стимулирующая собственный ответ на опухоль, может быть:
- Специфической — вакцины, приготовленные из раковых клеток, антигены опухолей;
- Неспецифической — в основе препаратов интерфероны, интерлейкины, фактор некроза опухолей;
- Комбинированной — сочетанное применение вакцин, противоопухолевых белков и стимулирующих иммунитет веществ.
Пассивная иммунотерапия при онкологии, в свою очередь, делится на:
Положительные факторы иммунопрепаратов
Лечение злокачественной опухоли проводится комплексно с применением всех видов терапевтического воздействия. Иммунотерапия обладает следующими основными достоинствами:
- Высокая эффективность при некоторых видах опухолей (вакцинация может стать лучшей профилактикой цервикального рака);
- Безопасность использования (малое количество побочного влияния на организм пациента);
- Возможность повышения значимости противоопухолевой защиты в борьбе с новообразованиями любой локализации;
- Изменение прогноза для жизни (существенное увеличение шансов на выживание).
Иммунотерапия при раке – это хорошее подспорье для врача-онколога, занимающегося лечением онкологических больных: с помощью простых лекарств можно оказать эффективное воздействие на противоопухолевый иммунитет.